
AI 预言家入局流感战场:VaxSeer 如何破解疫苗“押题”难题?
每当秋冬流感高发季来临,接种流感疫苗便成为了许多人尤其是易感人群的必修课。这似乎已成为一种公共卫生的共识:接种疫苗是预防流感最有效的手段。我们习惯于相信,那一针刺入上臂的液体,将成为我们度过寒冬的免疫盾牌。
然而,现实往往比愿望骨感。许多人在接种疫苗后依然“中招”,而在临床数据上,流感疫苗的保护效力也常常难以令人满意。根据美国疾病控制与预防中心(CDC)的估算,在2012年至2021年的10年间,针对门诊疾病的流感疫苗总体有效率平均低于 。这种保护力的缺失,不仅意味着个人的健康风险,更导致了流感相关住院率的持续上升。
为什么凝聚了现代医学智慧的疫苗,有时会显得如此“力不从心”?核心症结在于一场不得不进行的“赌博”。流感病毒变异极快,而疫苗的生产周期却长达6到9个月。这意味着,科学家们必须在每年2月就决定北半球下一个冬天(10月开始)要用什么毒株来制作疫苗。这种基于有限数据对未来大半年病毒流行趋势的“押题”,一旦失准,疫苗就会发生“抗原不匹配”,导致保护力大打折扣。
面对这一困境,科学家们不禁发问:我们能否利用人工智能,在病毒大流行之前就精准预测出未来的“毒王”,并计算出哪种疫苗候选株能对它们一击即中?
近日,来自麻省理工学院计算机科学与人工智能实验室(CSAIL)的研究团队在《自然·医学》(Nature Medicine)上发表了一项名为 VaxSeer 的突破性研究成果。这项技术并非简单的预测模型,而是一套结合了进化生物学与抗原性分析的AI系统,它试图为这场甚至关乎生死的“疫苗押题考”提供一个标准的AI解法。
1. 并不完美的“赌注”:时间差与进化赛跑
在深入了解 VaxSeer 之前,我们需要先理解当前疫苗选择面临的巨大挑战。世界卫生组织(WHO)的专家组每年会聚首两次,分别针对南北半球推荐疫苗毒株。他们的目标是最大化“疫苗有效性”(Vaccine Effectiveness, VE),即降低接种者感染流感的几率。
理想情况下,选定的疫苗毒株应与未来流感季流行的病毒株在抗原上高度匹配。一旦“押中”,灭活流感疫苗的有效性可达 。但在实际操作中,病毒的演化往往出人意料。例如在2014-2015年的冬季,由于主要的H3N2流感病毒发生了抗原漂移,该季度的疫苗有效性暴跌至仅 。
传统的流行病学研究通常假设病毒的进化是单个氨基酸突变的简单叠加,但这很难捕捉到蛋白质稳定性或宿主相互作用等更高维度的复杂特性。此外,要在实验室中通过血凝抑制(HI)试验来验证所有候选疫苗针对未来可能出现的病毒的有效性,不仅耗资巨大,而且在时间和样本量上都显得捉襟见肘。通常,只有不到10个候选疫苗能接受这种详尽的测试。
2. VaxSeer 的“双核”引擎:不仅仅是预测流行
针对上述痛点,研究团队提出了 VaxSeer 框架。它的核心创新在于将“疫苗选择”拆解为两个可被AI量化预测的关键维度:优势度(Dominance)与抗原性(Antigenicity)。
如图[1]所示,VaxSeer 就像一个精密的双轨道处理工厂,为每一个候选疫苗计算一个综合的“覆盖评分”(Coverage Score):
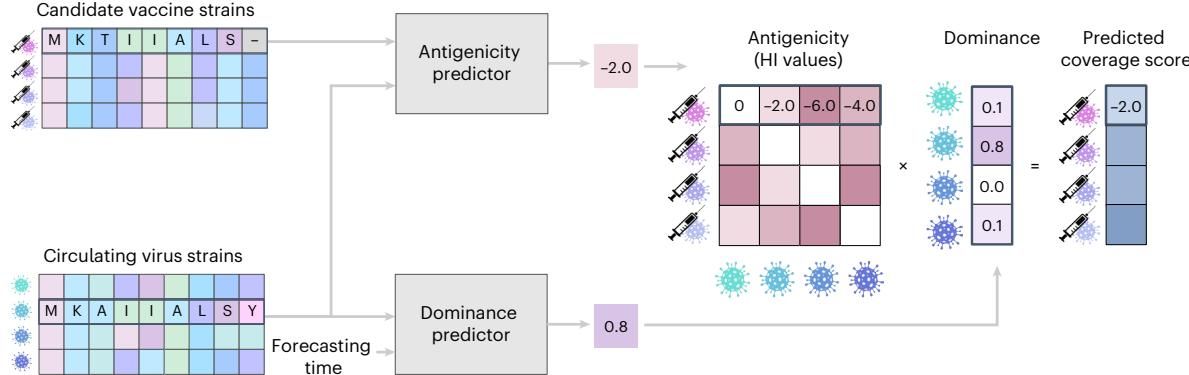
- 左侧轨道(优势度预测器): 这一部分关注的是“未来谁是主角”。研究人员利用基于Transformer的蛋白质语言模型,结合常微分方程(ODE),不仅学习病毒血凝素(HA)蛋白序列的静态特征,更捕捉其随时间变化的动态适应性。它能预测在未来的流感季,哪些病毒株会因为适应性强而占据主导地位。
- 中间轨道(抗原性预测器): 这一部分关注的是“疫苗能不能打”。模型接收一对蛋白质序列(一个是候选疫苗,一个是流行病毒),预测它们之间的血凝抑制(HI)测试结果。这一步极为关键,因为它使得计算机可以在硅基芯片上“虚拟”进行成千上万次昂贵的湿实验,从而筛选海量的候选疫苗。
- 右侧输出(覆盖评分): 最终,系统将疫苗针对不同病毒的抗原性预测值,按照这些病毒在未来的预测流行度进行加权平均,得出一个单一的、可用于排名的“覆盖评分”。
通过这张图我们可以清晰地看到 VaxSeer 的工作流:它不再依赖于“昨日的病毒”来设计“明日的疫苗”,而是试图构建一个包含未来流行趋势和抗原匹配度的全景图。这种“进化+抗原”的双重建模,正是 VaxSeer 区别于传统方法的核心所在。
3. 十年回溯:AI 挑选的疫苗“赢”在哪?
为了验证这套 AI 系统的实战能力,研究团队并没有急于将其推向临床,而是进行了一场严谨的“历史模拟考”。他们利用 2012 年至 2021 年这 10 年间的数据,针对 A/H3N2 和 A/H1N1 两种主要的流感亚型进行了回溯性测试。
结果令人振奋:VaxSeer 的表现显著优于 WHO 专家的年度推荐。 在以“经验覆盖评分”(Empirical Coverage Score,一种基于事后真实流行数据计算的评分)为标准的评估中,VaxSeer 推荐的疫苗株在 10 年里有 9 年在 H3N2 亚型上击败了 WHO 的选择;在 H1N1 亚型上,它也在 10 年中赢了 6 年。
如图[2]所示,这一优势并非偶然。在图[2]b 中,我们可以清楚地看到 H3N2 亚型历年的得分对比,橙色横线代表 VaxSeer 的选择,往往位于绿色横线(WHO 推荐)之上,甚至多次触及所有候选株中的“天花板”(蓝色叉号)。
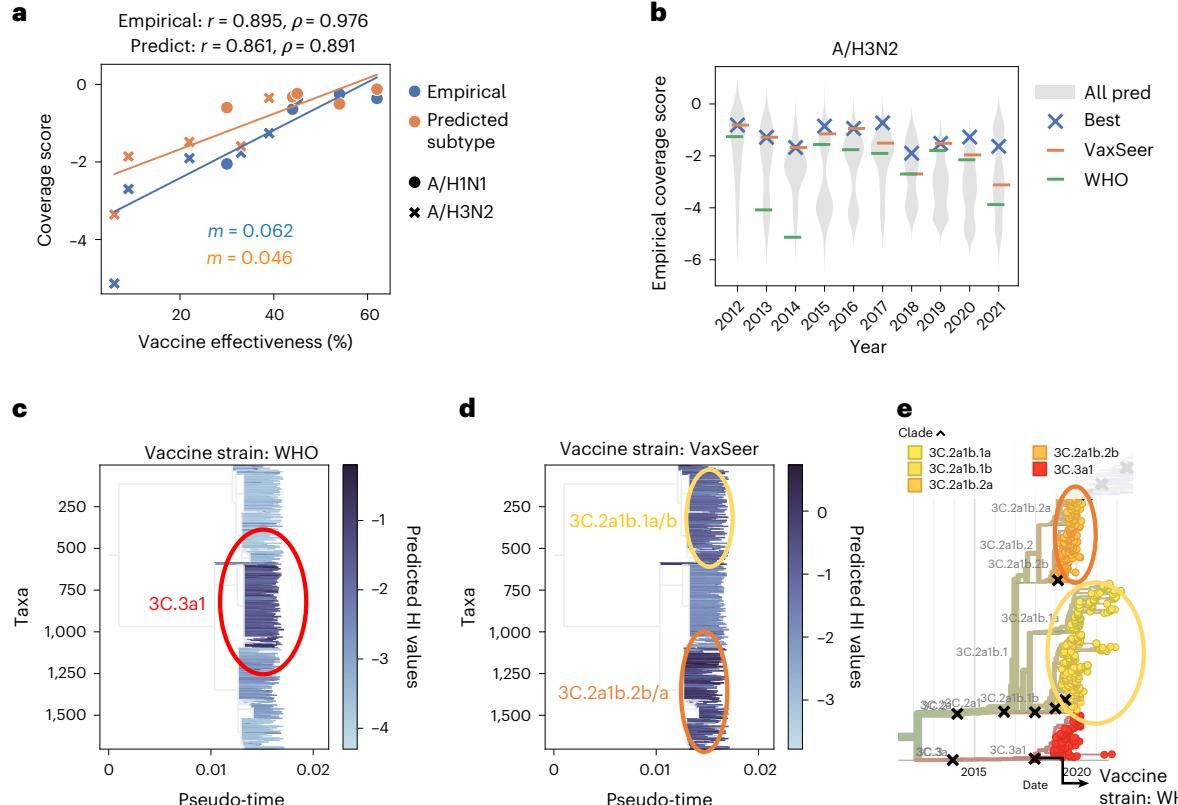
更值得玩味的是 VaxSeer “赢”的原因——它似乎拥有更敏锐的“进化嗅觉”。以 2019 年北半球冬季流感季为例,当时流感病毒正发生复杂的分化。WHO 专家组推荐的疫苗株主要针对当时的一个新兴分支 3C.3a1(图[2]c 红圈所示)。然而,VaxSeer 却把宝押在了另一个方向,其推荐的疫苗株主要覆盖了 3C.2a1b 分支(图[2]d 黄圈和橙圈所示)。
事后的系统发育树(图[2]e)揭示了真相:WHO 关注的分支虽然新颖,但并未成为绝对主流;而 VaxSeer 锁定的 3C.2a1b 分支不仅涵盖了广泛的流行毒株,而且其子分支(如 3C.2a1b.2a)在随后的季节中迅速扩张。AI 成功预判了病毒的“主力军”动向,从而选出了覆盖面更广的疫苗。
此外,图[2]b 中的小提琴图还向我们展示了另一种可能性:在那些灰色的阴影中,隐藏着许多得分极高但未被 WHO 合作中心选中进行深入实验的候选株。这意味着,VaxSeer 不仅能从现有选项中挑出最好的,还可能帮我们挖掘出那些被遗漏的“遗珠”。
4. 并非纸上谈兵:预测分数与真实防效的强关联
计算机算出的“高分”,真的能转化为现实世界中对人体的保护吗?这是所有计算生物学研究必须面对的终极拷问。为了回答这个问题,研究人员将 VaxSeer 的预测评分与美国 CDC 公布的历年流感疫苗有效性(VE)数据进行了比对。
分析结果证实了 VaxSeer 的核心假设:预测的覆盖评分与真实的疫苗有效性之间存在极强的正相关性。
如图[3]所示,研究人员对比了三种不同的评估策略与疫苗有效性的相关系数。如果我们仅仅看“疫苗在上一季度的流行度”(图[3]上),相关性非常低(),这说明照搬去年的热门毒株对防御今年的流感几乎没有指导意义。如果我们只看“平均抗原性”(图[3]中),虽然相关性显著提升,但仍不及 VaxSeer。
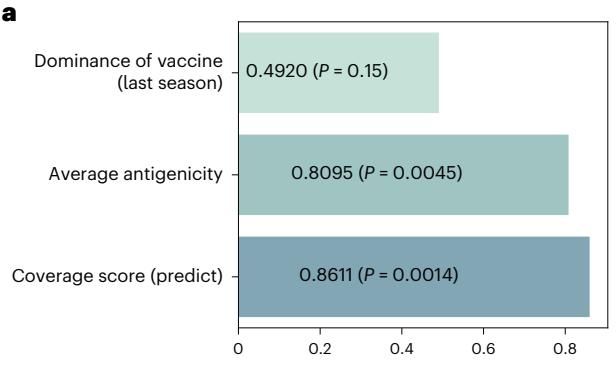
只有当我们将“未来的病毒流行度预测”与“抗原匹配预测”结合起来,即使用 VaxSeer 的“覆盖评分”(图[3]下)时,相关系数达到了最高的 0.8611()。这一结果有力地证明,准确预测病毒的未来进化方向,对于提升疫苗保护力至关重要。
此外,数据还显示,VaxSeer 的评分还能很好地反映疫苗在减少医疗就诊和缓解疾病负担方面的潜力。那些被 AI 打出高分的疫苗,在真实世界中往往对应着更少的流感就诊人数。这表明,VaxSeer 不仅仅是一个实验室工具,它有潜力直接服务于公共卫生决策,减少流感对社会医疗资源的挤兑。
5. 结语:迈向精准免疫的未来
VaxSeer 的出现,标志着疫苗株选育正在从“经验驱动”向“数据驱动”转型。作为一种低成本、高通量的 in silico(硅基/计算机模拟)工具,它并不是要取代现有的专家系统,而是提供了一个强有力的补充视角。
面对数以万计的病毒变异株,传统的湿实验只能筛选九牛一毛。而 VaxSeer 可以在短时间内对海量候选株进行“虚拟筛选”,将最有希望的候选者推送到专家面前,供实验室进行重点验证。这种人机结合的模式,有望大幅提升疫苗选育的成功率。
当然,VaxSeer 也并非全知全能。目前它主要依赖 HA 蛋白序列,尚未考虑神经氨酸酶(NA)等其他蛋白的影响;其训练数据也受限于 GISAID 数据库的采样偏差(如地理分布不均)以及用于抗原性测试的雪貂抗血清与人体免疫反应的差异。但随着测序技术的普及和更多高维度临床数据的积累,这些局限将逐步被突破。
在与病毒进化的永恒赛跑中,人类从未停止寻找更锋利的武器。这一次,AI 站在了起跑线上,为我们预见即将到来的风暴,并锻造出更坚固的盾牌。
论文信息
- 标题:Influenza vaccine strain selection with an AI-based evolutionary and antigenicity model.
- 论文链接:https://doi.org/10.1038/s41591-025-03917-y
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-11
- 期刊/会议:Nature medicine
- 作者:Wenxian Shi, Jeremy Wohlwend, Menghua Wu, Regina Barzilay
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
References
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/y39rrjpitfcdo7apall72wdc_1_76b3cb76ab.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/y39rrjpitfcdo7apall72wdc_2_eb95e175be.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/y39rrjpitfcdo7apall72wdc_3_5b5f418437.jpg
分享
推荐阅读

CRISPR"隐形"细胞:糖尿病患者6个月不打胰岛素
2024年12月,一名1型糖尿病患者接受了经过CRISPR编辑的供体胰岛细胞移植。六个月后,这些细胞依然在他手臂肌肉里稳定工作,无需任何免疫抑制药物。这是细胞治疗领域的分水岭时刻。

CAR-T 疗法治愈狼疮?癌症疗法转战自身免疫病的突破
2024年NEJM发表重磅研究:德国团队用CAR-T细胞疗法治疗15名重症自身免疫病患者,100%达到缓解。从癌症到狼疮,这场医学革命正在改写千万患者的命运。

FDA批准阿尔茨海默血液检测:$500测试替代$6000 PET扫描

MIT开源BoltzGen:AI设计蛋白质药物,向"不可成药"靶点宣战
MIT团队推出开源AI模型BoltzGen,在26个挑战性靶点上实现纳摩尔级结合亲和力,67%成功率打破蛋白质设计困境,免费商用或颠覆制药行业格局。