
减肥神药“王中王”之战:替尔泊肽与司美格鲁肽,谁更护心?
在当今的生物医药领域,没有任何一类药物能像GLP-1受体激动剂那样,掀起如此巨大的波澜。从最初用于治疗2型糖尿病,到后来在减重领域的“封神”,司美格鲁肽(Semaglutide)几乎成为了家喻户晓的名字。而在其身后,更为强劲的挑战者——替尔泊肽(Tirzepatide),作为一种兼具GIP和GLP-1双重受体激动剂,凭借着更为惊人的降糖与减重效果,正不仅在市场上,也在科学界发起猛烈的攻势。
众所周知,肥胖与糖尿病是心血管疾病的重大推手。既然替尔泊肽在控制血糖和减轻体重方面表现出了优于司美格鲁肽的潜力,那么一个符合直觉的推论便是:它在保护心脏、预防心梗和卒中方面,理应也拥有“降维打击”般的优势。
然而,医学循证的道路从未如此简单直接。尽管替尔泊肽在减重数字上更胜一筹,但目前尚缺乏两者在心血管结局上的直接“头对头”随机对照临床试验(RCT)数据。医生和患者都面临着一个巨大的困惑:在预防致命的心血管事件上,究竟是坚守经过时间考验的“老将”司美格鲁肽,还是拥抱数据华丽的“新贵”替尔泊肽?
为了填补这一关键的证据真空,来自哈佛医学院布列根和妇女医院的研究团队,利用覆盖全美数百万人的医保理赔数据库,进行了一项规模宏大的“目标试验模拟”(Target Trial Emulation)。这项刚刚发表在《自然·医学》(Nature Medicine)上的重磅研究[1],为我们揭开了这两大“药王”在真实世界中心血管护航能力的真相。
 figure1
figure1
1. 并没有发生的“降维打击”
本研究的核心科学问题非常明确:在真实世界的临床实践中,对于患有2型糖尿病且具有心血管风险的患者,替尔泊肽在预防主要不良心血管事件(MACE,包括心梗、卒中和全因死亡)方面,是否优于司美格鲁肽?
研究团队首先通过模拟著名的SUSTAIN-6和SURPASS-CVOT试验,验证了其分析框架的准确性,随后在扩展的真实世界人群中进行了直接的“头对头”比较。如图[2]所示,研究设计精妙地模拟了随机对照试验的流程:从庞大的非入组人群中筛选出符合资格的297,842名患者,利用倾向性评分匹配(Propensity Score Matching)技术,构建了两个在基线特征上高度平衡的队列,分别接受替尔泊肽和司美格鲁肽治疗,旨在为低、中、高心血管风险的2型糖尿病及肥胖患者提供治疗决策依据。
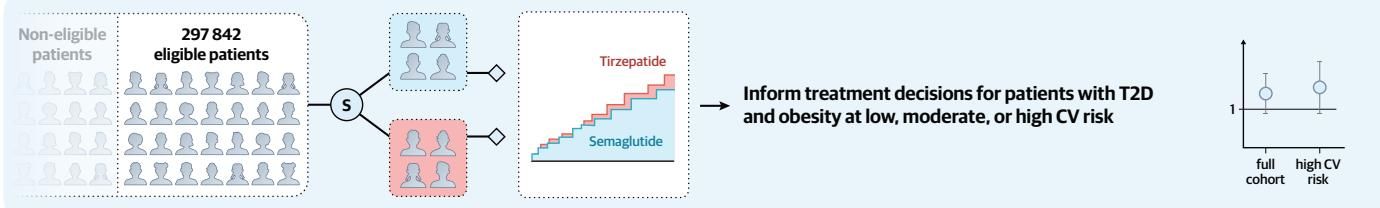
研究结果出人意料,却又情理之中:并未发现显著差异。
在平均随访期间,替尔泊肽组与司美格鲁肽组在主要复合终点(MACE)上的发生率惊人地相似。如图[3]所示,代表替尔泊肽(红色曲线)和司美格鲁肽(蓝色曲线)的累积发病率线条在随访的一年多时间里几乎纠缠在一起,难分伯仲。具体数据显示,两组的风险比(Hazard Ratio, HR)为1.06(95% CI, 0.95-1.18)。从图中我们可以清晰地解读出关键信息:两条曲线周围的阴影区域(代表置信区间)大面积重叠,且HR值的置信区间跨越了1(即无差异线),这意味着在统计学上,替尔泊肽并没有表现出优于、甚至在数值上还略微(尽管不显著)逊色于司美格鲁肽的心血管保护效应。
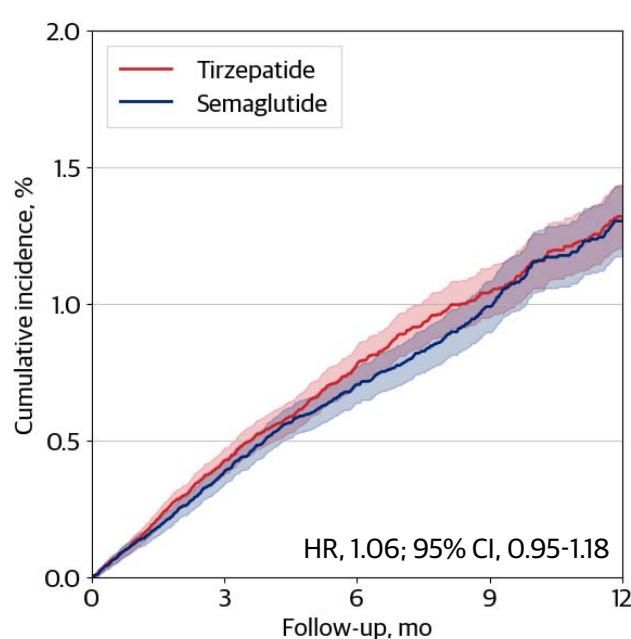
这一发现挑战了“减重越多=心血管获益越大”的简单线性逻辑。尽管替尔泊肽是双靶点激动剂,但其对GLP-1受体的亲和力低于司美格鲁肽,且其独特的信号传导偏向性可能导致了不同的下游生物学效应。此外,研究人员指出,GIP受体激动剂在心血管生物学中的作用尚存争议,从潜在的心脏保护到可能增加血管炎症,其机制比单纯的GLP-1更为复杂。
2. 真实世界的“试金石”:验证与扩展
这项研究的另一大价值在于其严谨的方法学——“目标试验模拟”。真实世界数据(RWD)常因混杂因素(如医生更倾向于给病情重的人开某种药)而饱受诟病。为了证明结论的可靠性,研究团队不仅做了“头对头”比较,还先做了一轮“基准测试”。
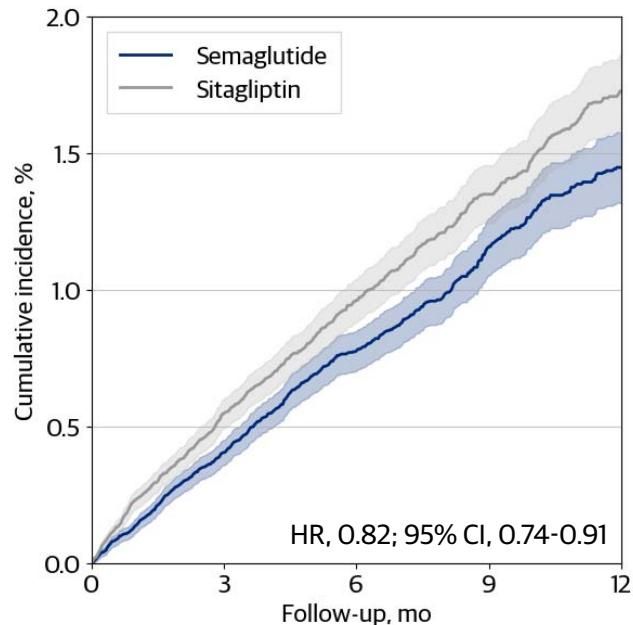
他们利用同样的数据库和统计方法,先模拟了已经完成的临床试验。例如,他们模拟了SUSTAIN-6试验(司美格鲁肽 vs. 安慰剂/西格列汀)。结果显示,在扩展人群中,司美格鲁肽相较于西格列汀(作为安慰剂代理)显著降低了心血管风险(HR 0.82)。如图[4]所示,司美格鲁肽组(蓝色线)的累积发病率明显低于西格列汀组(灰色线),且两条曲线在随访早期就已分道扬镳,这与已发表的随机对照试验结果高度一致,从而有力地证实了该研究分析方法的可靠性。
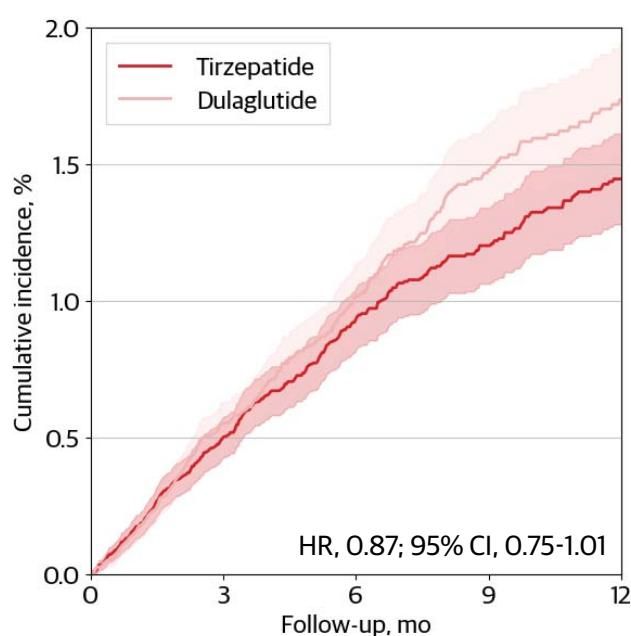
同样,在模拟SURPASS-CVOT试验(替尔泊肽 vs. 度拉糖肽)时,研究发现替尔泊肽表现出了与度拉糖肽相当、甚至略优的心血管保护趋势(HR 0.87)。如图[5]所示,虽然替尔泊肽(深红线)看起来比度拉糖肽(浅红线)风险更低,但置信区间(阴影部分)仍有重叠,且跨越了无效线(95% CI 0.75-1.01),这提示在统计学上这是一种“非劣效”甚至是潜在的优效表现。这一结果不仅为替尔泊肽的心血管安全性背书,也为后续的头对头比较奠定了坚实的信任基础。
3. 细微之处见真章:亚组与安全性的考量
虽然在主要终点上打了个平手,但在某些次要终点和亚组分析中,数据还是透露出了一些微妙的信息。
在心力衰竭(Heart Failure)相关结局上,替尔泊肽显示出了微弱的优势信号(HR 0.91),尽管这一差异在统计学上尚未达到显著性。这可能与替尔泊肽更强大的减重效果有关,因为体重减轻对心力衰竭(特别是射血分数保留的心衰)的改善作用更为直接。
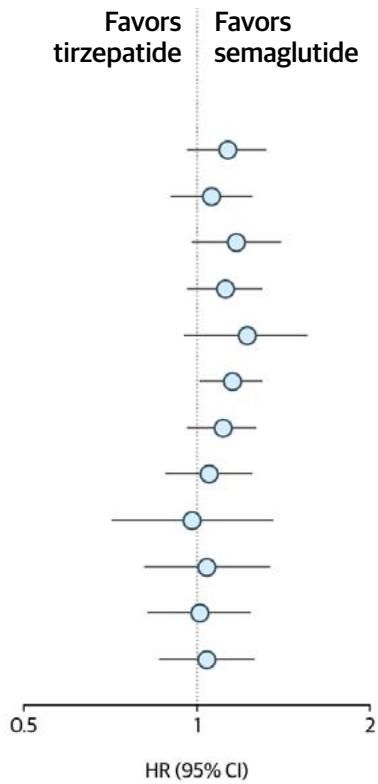
如图[6]的森林图所示,在针对替尔泊肽与司美格鲁肽的详细亚组分析中,无论是按年龄、性别,还是是否合并使用SGLT2抑制剂,HR值的点估计大多落在1附近。然而,值得注意的是,在某些特定高风险亚组中,点估计值略微偏向司美格鲁肽(即HR > 1),虽然都未达统计显著,但这提示我们:对于已经建立的高危心血管疾病患者,司美格鲁肽目前积累的证据或许更为“硬核”。
安全性方面,两者表现出了相似的特征,但在严重细菌感染的风险上,两者均优于各自的对照组(西格列汀和度拉糖肽),这可能与血糖控制改善带来的免疫获益有关。
4. 写在最后:不必等待的答案
这项发表于《自然·医学》的研究,通过高质量的真实世界证据,提前回答了一个临床急需解决的问题。结论是清晰的:在预防2型糖尿病患者的心血管事件方面,替尔泊肽与司美格鲁肽表现相当。
对于临床医生和患者而言,这意味着在选择药物时,可以将关注点更多地放在其他因素上——例如患者对减重的具体需求(替尔泊肽更强)、胃肠道耐受性、药物的可及性以及经济负担,而不必过分纠结于谁更能“护心”。
虽然我们仍需等待未来的随机对照试验(如正在进行的SURPASS-CVOT)来提供最终的裁决,但当下的这份“晨报”告诉我们:无论是老牌王者,还是新晋挑战者,它们都是保护心血管健康的有力武器。在这场“王中王”的对决中,最大的赢家,其实是拥有了更多治疗选择的患者。
论文信息
- 标题:Cardiovascular outcomes of semaglutide and tirzepatide for patients with type 2 diabetes in clinical practice.
- 论文链接:https://doi.org/10.1038/s41591-025-04102-x
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-11-9
- 期刊/会议:Nature medicine
- 作者:Nils Krüger, Sebastian Schneeweiss, Rishi J Desai, ..., Shirley V Wang
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
References
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/fhmtnid82bhzv2oaeqw7fhyb_1_88dcf597c0.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/fhmtnid82bhzv2oaeqw7fhyb_2_45c496ec77.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/fhmtnid82bhzv2oaeqw7fhyb_3_cc5cd6e92f.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/fhmtnid82bhzv2oaeqw7fhyb_4_aa47143a78.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/fhmtnid82bhzv2oaeqw7fhyb_5_c97b4a9060.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/fhmtnid82bhzv2oaeqw7fhyb_6_717d2735ce.jpg
分享
推荐阅读

CAR-T 疗法治愈狼疮?癌症疗法转战自身免疫病的突破
2024年NEJM发表重磅研究:德国团队用CAR-T细胞疗法治疗15名重症自身免疫病患者,100%达到缓解。从癌症到狼疮,这场医学革命正在改写千万患者的命运。

FDA批准阿尔茨海默血液检测:$500测试替代$6000 PET扫描

CRISPR"隐形"细胞:糖尿病患者6个月不打胰岛素
2024年12月,一名1型糖尿病患者接受了经过CRISPR编辑的供体胰岛细胞移植。六个月后,这些细胞依然在他手臂肌肉里稳定工作,无需任何免疫抑制药物。这是细胞治疗领域的分水岭时刻。

Nature Medicine重磅:一次输注,长期治愈?中国血友病B基因疗法交出亮眼答卷
中国医学科学院血液病医院张磊教授团队与Belief Biomed合作,在《Nature Medicine》发表血友病B基因疗法BBM-H901的I/II及III期临床成果,显示一次输注显著降低出血率,提升凝血因子活性,有望实现长期治愈。