
长期服用安眠药:深睡眠流失与记忆神经通路阻断的隐性代价
对于许多饱受失眠折磨的老年人来说,能“睡着”似乎就是全部的诉求。为了通过这一关,苯二氮卓类药物(BZD)及其受体激动剂(BZRA,即所谓的“Z类药物”)成为了床头柜上的常客。然而,睡着了真的等同于睡好了吗?
既往的共识往往聚焦于药物带来的副作用,如次日的困倦或跌倒风险。但发表在顶刊《睡眠》(Sleep)上的一项最新研究揭示了一个更为隐蔽且令人担忧的事实:长期服用镇静催眠药物,不仅无法恢复正常的睡眠结构,反而可能通过破坏脑波之间的精密“耦合”,切断了记忆巩固的关键神经通路。
这项由加拿大康考迪亚大学(Concordia University)睡眠、认知与神经影像实验室主导的研究,深入探索了长期服用镇静催眠药物对老年人睡眠宏观架构与微观脑振荡的深层影响。其结论挑战了许多人的固有认知:药物诱导的睡眠,可能只是披着睡眠外衣的“认知损耗”。
1. 并没有“被治愈”的睡眠:从宏观架构看药物的局限性
在探讨药物影响之前,我们需要了解一个残酷的现实:失眠本身已经是一种折磨,但药物介入后,情况似乎并没有向着“自然睡眠”的方向好转。
这项研究纳入了101名年龄在55至80岁之间的参与者,研究人员巧妙地将他们分为了三组进行横向对比:
- 优质睡眠组(GS):无睡眠障碍的健康老年人。
- 未服药失眠组(INS):患有慢性失眠障碍但坚持不使用药物的患者。
- 长期服药组(MED):患有慢性失眠障碍,且长期(平均使用时长约11年,每周至少3晚)服用BZD或BZRA类药物的患者。
如图[1]所示,研究团队不仅关注了传统的睡眠阶段划分(宏观架构),更利用高密度脑电图(EEG)深入到了脑波的微观世界,旨在捕捉那些常规检查难以发现的神经生理改变。
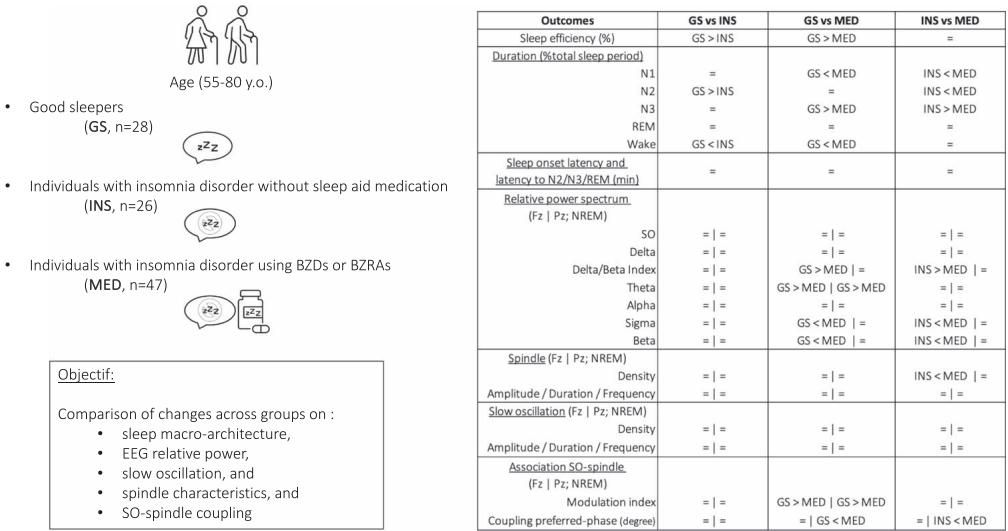
研究结果首先在睡眠的“宏观架构”上给出了警示。通常人们认为服药是为了睡得更沉,但数据却指向了相反的方向。与未服药的失眠患者(INS)和健康人(GS)相比,长期服药组(MED)表现出了明显的睡眠结构退化。
从图[2]中我们可以清晰地看到这种差异:

- 深睡眠的匮乏:长期服药组的慢波睡眠(N3阶段,即深睡眠)比例显著低于其他两组。N3阶段是身体修复和大脑“清洗”代谢废物的关键时期,其缺失与认知功能下降密切相关。
- 浅睡眠的泛滥:服药组在N1浅睡眠阶段花费的时间显著多于另外两组;而在N2阶段,服药组的时长也显著高于未服药的失眠患者。N1阶段通常被视为睡眠与清醒的过渡期,过多的N1意味着睡眠深度不足,容易被外界干扰打断。
- 睡眠效率并未优势显著:虽然药物旨在帮助入睡,但长期服药组的整体睡眠效率(Sleep Efficiency)甚至低于健康对照组,且与未服药的失眠患者相比,并未在减少觉醒时间上展现出“治愈性”的优势。
这一结果揭示了一个尴尬的现状:药物虽然可能缩短了主观感觉上的入睡时间,但它所构建的“睡眠大厦”地基并不稳固——它实际上是用低质量的浅睡眠,置换了宝贵的深睡眠。
2. 脑波微观战场:被药物重塑的频谱
当我们把目光从睡眠阶段的宏观比例转向脑电波的微观频谱时,药物带来的改变显得更为剧烈且复杂。研究人员通过频谱分析发现,长期服用镇静催眠药物的大脑,展现出一种独特的失衡状态。
如图[3]所示,通过对比三组人群在非快速眼动睡眠(NREM)期间的脑电功率谱,我们可以观察到显著的差异:
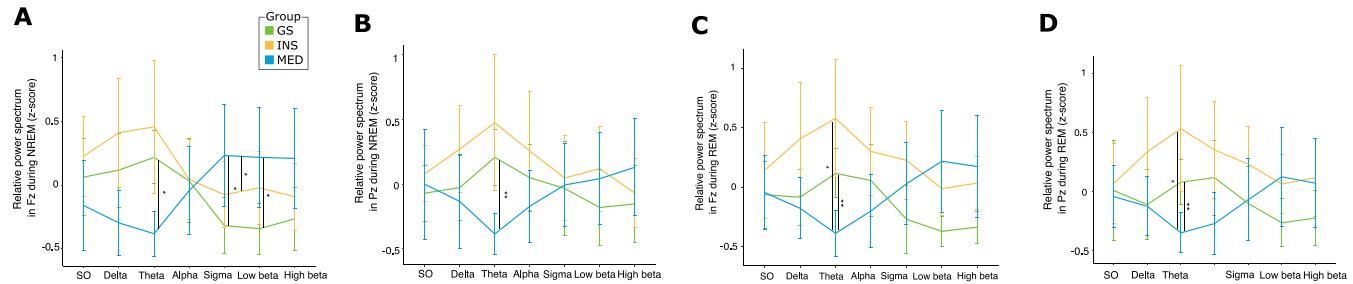
- Theta波的全面撤退:Theta波通常与深度放松和睡眠维持有关。然而,在长期服药组(MED)中,无论是额叶(图[3]A)还是顶叶(图[3]B)区域,Theta波的相对功率都出现了显著下降。这种抑制作用可能源于药物对GABA受体的持续调节,使得大脑难以维持正常的低频振荡活动。
- Sigma波的异常亢奋:与健康组相比,服药组在Sigma频段(11.25–16 Hz,与纺锤波活动密切相关)表现出了更高的活跃度(图[3]A)。虽然纺锤波本身具有保护睡眠的作用,但在药物影响下,这种活动的增强可能并不代表功能的提升,反而掩盖了其他频段的异常。
3. 断裂的记忆“握手”:慢波与纺锤波的失谐
本研究最核心、也是最具警示意义的发现,在于揭示了药物对睡眠中记忆巩固机制的破坏。在健康的深睡眠中,大脑皮层的慢波振荡(Slow Oscillations, SO)与丘脑产生的睡眠纺锤波(Spindles)之间存在着一种精密的“共舞”关系。这种被称为“相位-振幅耦合(PAC)”的同步活动,被认为是将短期记忆转化为长期记忆的关键神经机制——就像是将数据写入硬盘的瞬间,写入磁头必须在盘片旋转到正确位置时精准落下。
然而,镇静催眠药物似乎打乱了这一节奏。
虽然药物本身具有促进纺锤波生成的特性(事实上,服药组在额叶区域的纺锤波密度确实增加了,如图[4]A左侧所示),但这增加的纺锤波似乎成了“无效动作”。
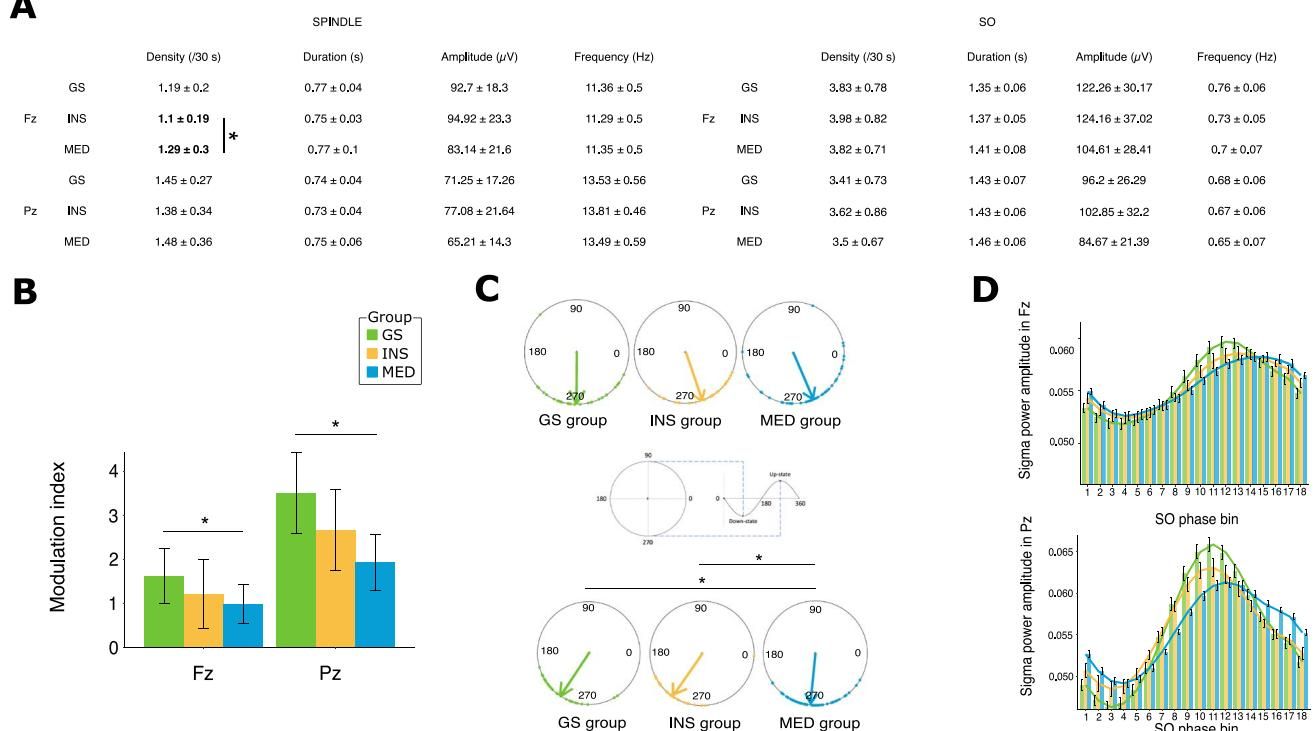
从图[4]中我们可以看到这种破坏的具体表现:
- 耦合强度的减弱:通过调制指数(Modulation Index)衡量,服药组(MED)的慢波与纺锤波之间的耦合强度显著低于健康组(图[4]B)。这意味着两者之间的同步性变差,“握手”变得松散而无力。
- 关键时机的错位:图[4]C展示了耦合的相位极坐标图。可以清晰地看到,与健康组(绿色箭头)相比,服药组(蓝色箭头)的优选耦合相位出现了明显的延迟。这种时序上的错位(图[4]D中的直方图也直观呈现了这一点)意味着纺锤波错过了慢波激发的最佳“窗口期”。
这一发现具有极高的临床价值:它提示我们,长期服用BZD或BZRA类药物虽然在表面上维持甚至增加了某些睡眠脑波特征(如纺锤波密度),但实际上却破坏了它们之间的功能性连接。这种神经振荡的“失谐”,很可能切断了睡眠对记忆和认知的保护作用,为老年人群中常见的药物相关性认知衰退提供了潜在的病理生理学解释。
4. 剂量陷阱:药量越大,离“真睡眠”越远
这项研究不仅揭示了“服药”与“不服药”的区别,更进一步剖析了药物剂量与使用时长的累积效应。对于那些试图通过增加药量来维持疗效的患者来说,数据给出了严厉的警告。
如图[5]所示,研究人员在长期服药组内部发现了一个明显的剂量依赖关系:
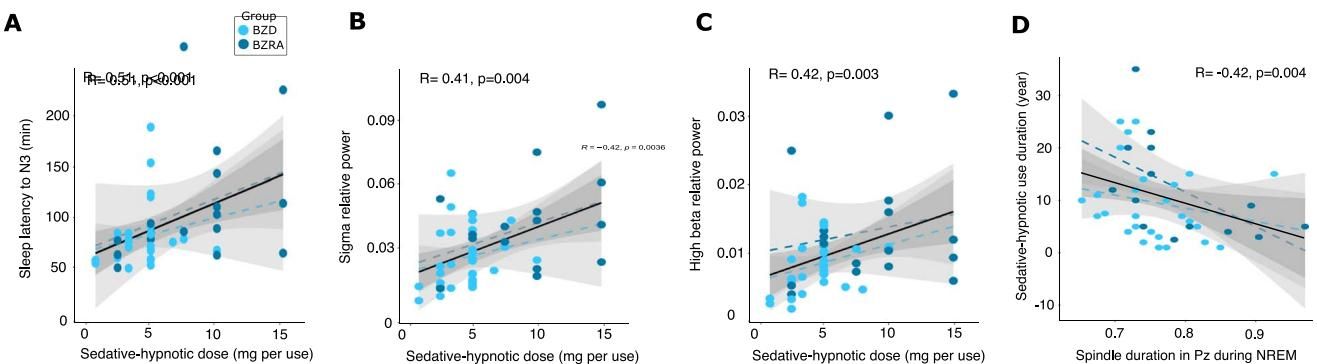
- 入睡更难:随着单次服用剂量的增加(折算为地西泮当量),患者进入深睡眠(N3阶段)的潜伏期反而显著延长(图[5]A)。这意味着,药吃得越多,大脑通往修复性深睡眠的道路反而越漫长。
- 异常活跃:高剂量还与NREM睡眠期间更高的高频脑波活动(Sigma和Beta波)相关(图[5]B, [5]C)。这种高频活动的增加通常被视为皮层唤醒水平提高的标志,表明大脑并未真正“镇静”下来,而是处于一种病理性的亢奋状态。
- 长期使用的磨损:此外,服药年限的延长也并非毫无代价。数据显示,长期使用镇静催眠药物与顶叶区域纺锤波持续时间的缩短呈负相关(图[5]D)。
值得注意的是,研究还对比了苯二氮卓类药物(BZD)与新型的Z类药物(BZRA)。尽管临床上常认为Z类药物副作用更小、代谢更快,但在对睡眠微观结构的破坏力上,两者表现得“半斤八两”。在调整剂量差异后,两类药物对睡眠架构和脑振荡的影响并无统计学差异。这提示我们,试图通过更换药物类别来规避风险,可能只是一种美好的愿望。
论文信息
- 标题:Effect of chronic benzodiazepine and benzodiazepine receptor agonist use on sleep architecture and brain oscillations in older adults with chronic insomnia.
- 论文链接:https://doi.org/10.1093/sleep/zsaf168
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-10-13
- 期刊/会议:Sleep
- 作者:Loïc Barbaux, Aurore A Perrault, Nathan E Cross, ..., Thien Thanh Dang-Vu
本文由超能文献“资讯AI智能体”基于4000万篇Pubmed文献自主选题与撰写,并经AI核查及编辑团队二次人工审校。内容仅供学术交流参考,不代表任何医学建议。
分享



