
72%晚期患者的噩梦:科学家找到阻断前列腺癌骨转移的关键“阀门”
在前列腺癌的治疗领域,一直存在着一个残酷的“分水岭”。
对于早期患者来说,通过手术或激素疗法,病情往往能得到有效控制。然而,一旦癌症发展到“去势抵抗性前列腺癌”(CRPC)阶段,情况就会急转直下。这不仅仅是因为癌细胞对常规的激素疗法产生了耐药性,更因为它们获得了一种可怕的能力——转移。
统计数据显示,约 72% 的去势抵抗性前列腺癌患者最终会发生骨转移。一旦癌细胞“啃”进了骨头,患者的平均生存期仅剩21个月左右,且伴随着剧烈的骨痛和骨折风险。这成为了绝大多数晚期患者死亡的主要原因。
为什么癌细胞偏偏喜欢往骨头里钻?长久以来,科学家们猜测这与骨骼中丰富的钙有关。最近,一项发表在《Signal Transduction and Targeted Therapy》上的重磅研究终于揭开了这个谜题的一角:原来,癌细胞为了在富含钙质的骨骼中生存和壮大,竟然进化出了一套专属的“钙吸收通道”和“导航系统”。
这项由法国里尔大学等机构完成的研究,不仅找到了控制这一过程的关键“阀门”,还提出了一种双管齐下的新疗法,有望为晚期患者带来新的生机。
1. 潜伏的“内鬼”:TRPV6钙通道
我们都知道,钙是人体必需的矿物质,尤其对骨骼至关重要。但你可能想不到,对于前列腺癌细胞来说,钙离子更是一种让它们“兴奋”和“变强”的兴奋剂。
研究人员将目光锁定在了一种名为 TRPV6 的蛋白质上。这是一种位于细胞膜上的通道,专门负责把细胞外的钙离子“搬运”到细胞内。在健康的成年人前列腺组织中,这个通道几乎是关闭或缺失的。但是,当研究人员分析了大量癌症患者的组织样本后,发现了一个惊人的现象。
TRPV6在癌细胞中“苏醒”了。
如图[1]所示,研究团队对比了正常骨髓组织和转移到骨骼的前列腺癌组织,发现TRPV6基因的表达量在骨转移灶中显著升高。更有意思的是,他们对37名患者进行了长达10年的追踪,结果发现:TRPV6表达水平越高的患者,其生存率越低。
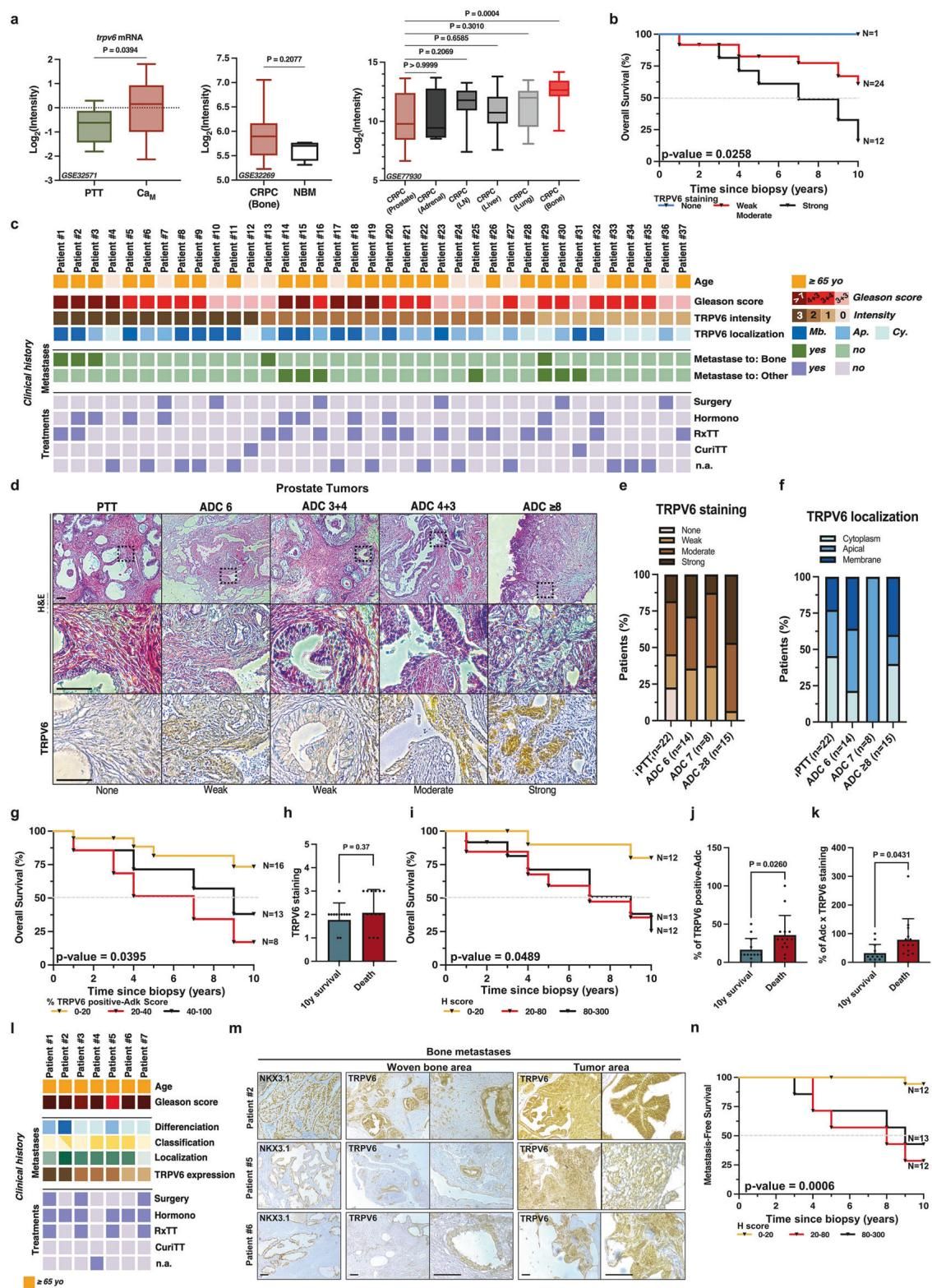
从图[1]的生存曲线(b图)中可以清晰地看到,那些TRPV6呈强阳性(黑线)的患者,其生存时间明显短于阴性或弱阳性(红线)的患者。这说明,TRPV6不仅仅是一个旁观者,它很可能是导致癌症恶化和转移的“元凶”之一。
1.1 癌细胞的“变身”秘密
为什么多了个钙通道,癌细胞就变得如此凶残?
研究揭示,TRPV6就像一个不断向细胞内输送“战斗指令”的指挥官。当它开启时,大量钙离子涌入细胞,激活了一系列信号通路(主要是CaMK2和NF-κB)。这一连串的反应最终导致癌细胞发生了上皮-间充质转化(EMT)。
简单来说,就是癌细胞从原本安分守己、彼此紧密连接的状态,变成了一种松散、善于运动和钻营的形态。它们开始分泌一种名为MMP的酶,这种酶就像“钻头”一样,能溶解周围的组织,让癌细胞得以逃离原发部位,进入血管,开启罪恶的转移之旅。
2. 致命搭档:给癌细胞装上“骨骼导航”
如果说TRPV6让癌细胞具备了“逃跑”的能力,那么它还需要一个精准的“导航仪”才能找到骨骼这个特定的目的地。研究团队发现,这个导航仪就是 CXCR4受体。
CXCR4是一种能接收特定化学信号的接收器,而骨髓恰恰是这种信号(CXCL12)的高产区。这解释了为什么前列腺癌细胞对骨头情有独钟——它们是被“召唤”过去的。
但这项研究最突破性的发现在于:TRPV6与CXCR4竟然是一对物理上紧密绑定的“致命搭档”。
研究人员发现,TRPV6通道和CXCR4受体在癌细胞表面形成了一个复合物。TRPV6就像是给CXCR4这个“导航仪”装上了“强力电池”。通过TRPV6进入细胞的钙离子,能够显著增加CXCR4在细胞表面的数量和活性,让癌细胞对骨骼发出的信号更加敏感。
如图[2]所示,这种组合的威力在动物实验中得到了证实。研究人员通过心内注射的方式模拟了癌细胞的全身转移过程:
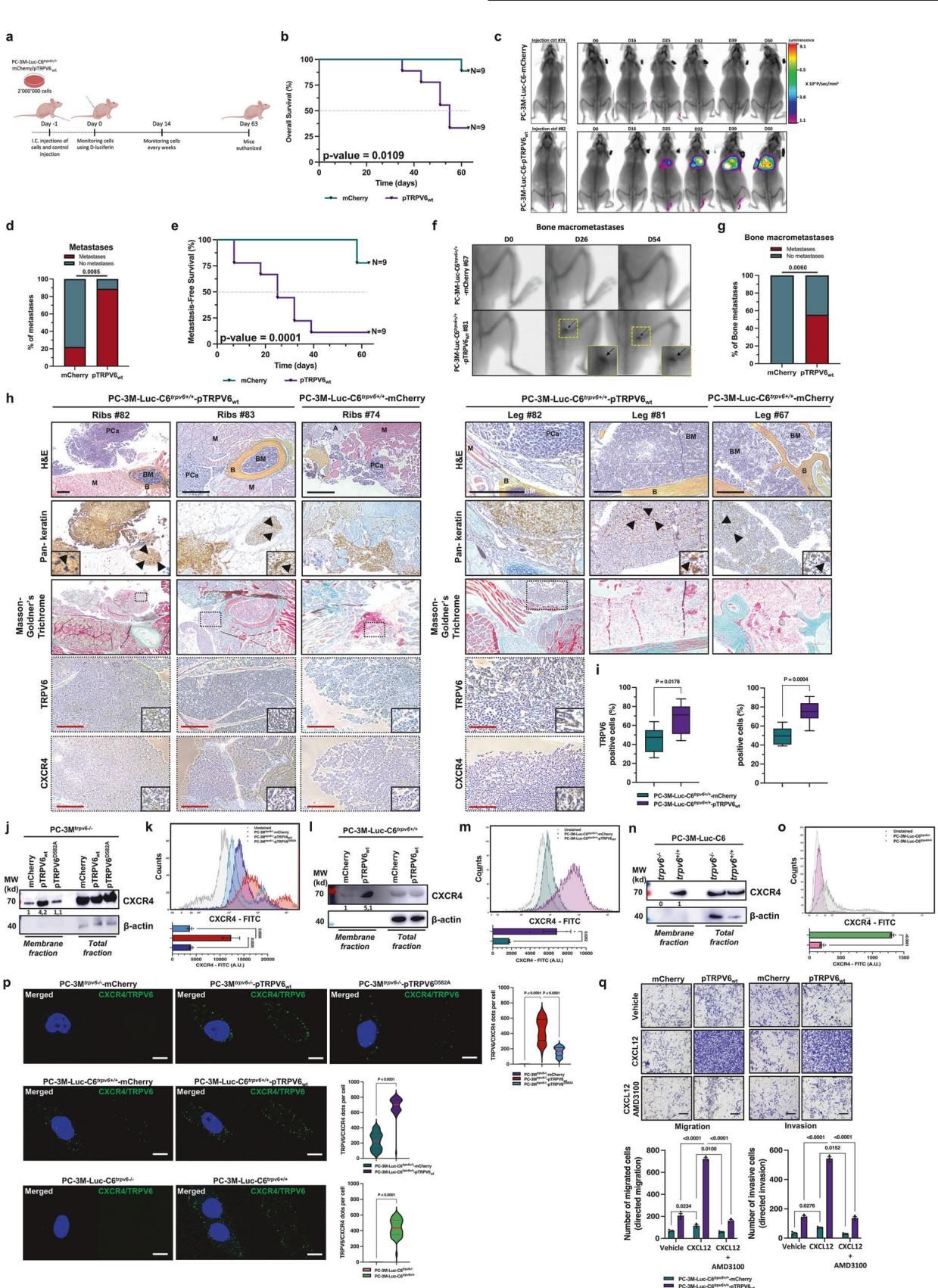
- 荧光成像显示:拥有功能性TRPV6/CXCR4复合物的癌细胞(如pTRPV6wt组),能够迅速锁定并“定居”在小鼠的腿骨和肋骨中,形成了强烈的转移灶信号。
- 数据对比:相比之下,那些缺乏TRPV6或CXCR4功能的癌细胞,就像断了电的导航仪,迷失了方向,发生骨转移的概率大幅下降。
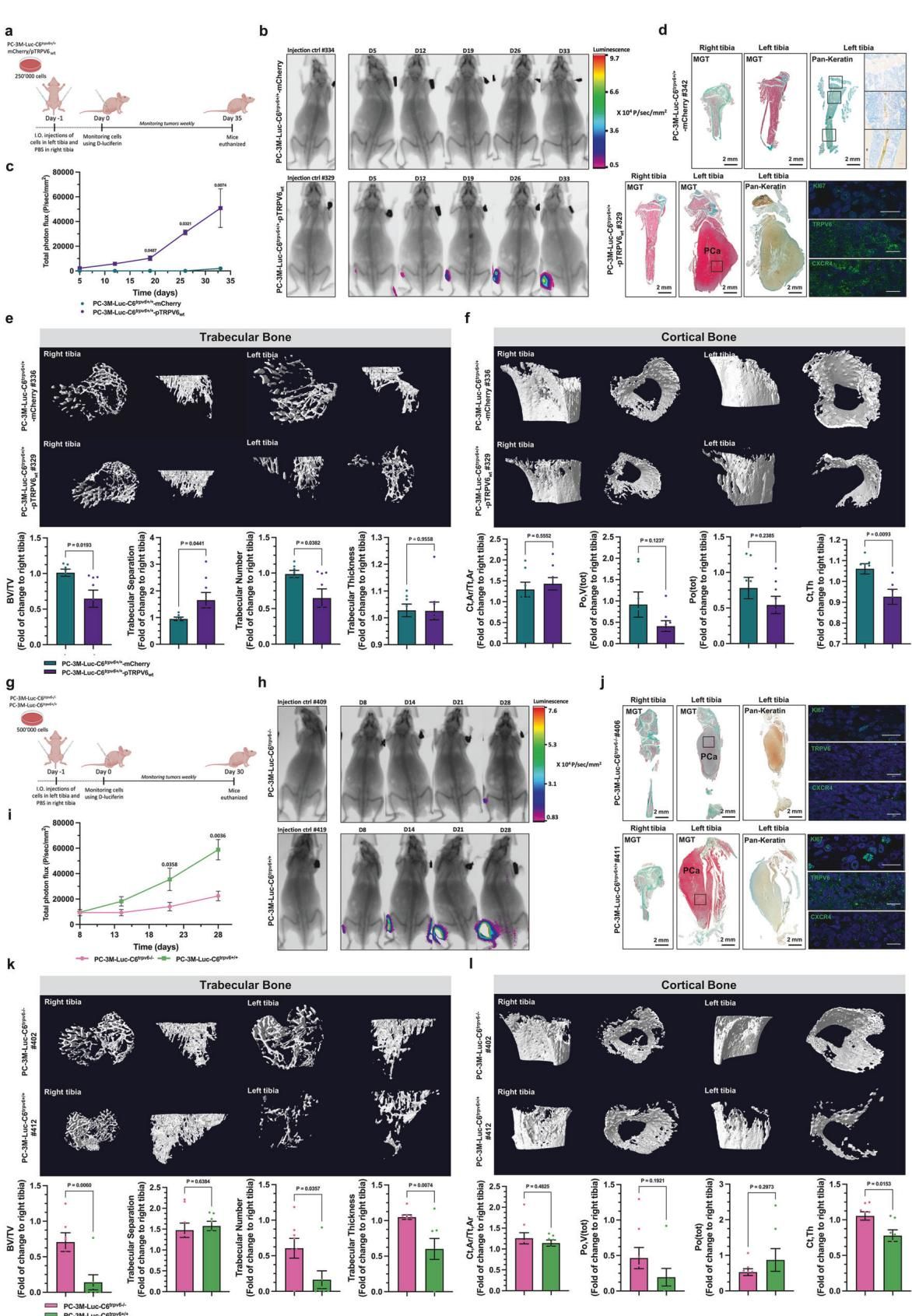
更糟糕的是,这对搭档不仅负责“带路”,到了骨头里还在继续作恶。如图[3]所示,癌细胞在骨髓中定植后,会显著改变骨骼的微结构,导致骨小梁数量减少、骨质流失(溶骨性破坏),这正是晚期患者遭受极度骨痛和病理性骨折的根源。
3. 绝地反击:双靶点疗法的希望
既然找到了“内鬼”和“导航仪”,科学家们自然想到了对策:能不能把它们同时关掉?
目前,针对CXCR4的抑制剂(如AMD3100)已经在临床上有所应用,但单打独斗的效果往往不够理想。而这项研究提出了一种全新的“组合拳”策略:同时使用针对TRPV6的单克隆抗体(mAb82)和CXCR4抑制剂。
如图[4]所示,研究人员在小鼠模型上验证了这种疗法的效果:
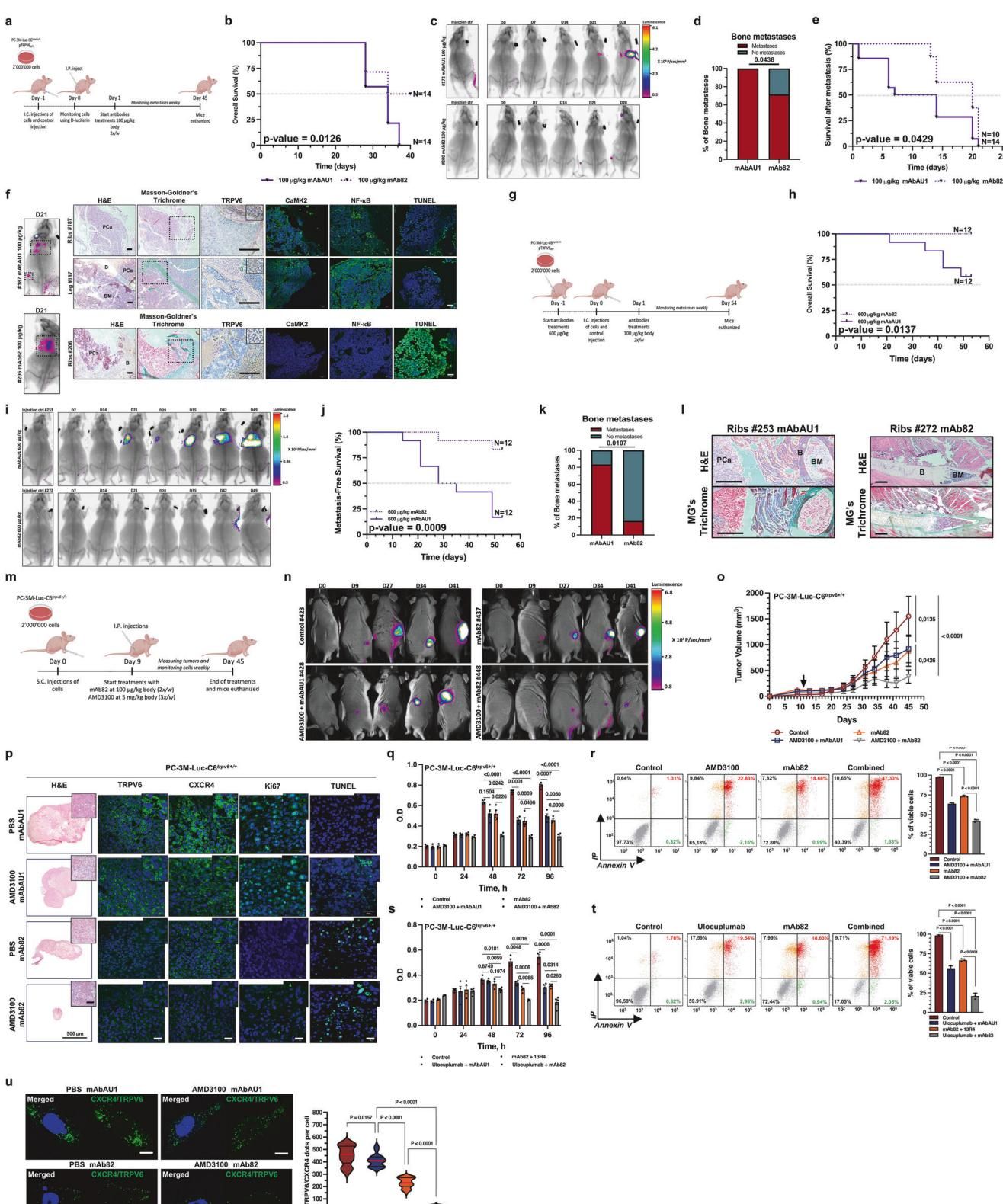
- 单药作战:单独使用抗TRPV6抗体(mAb82),就已经能显著抑制肿瘤生长,并将骨转移的风险降低约60%。如果能在癌细胞进入血液前提前用药,保护效果甚至能达到70%。
- 双剑合璧:当抗体与CXCR4抑制剂(AMD3100)联合使用时,奇迹发生了。从图[4]中的肿瘤生长曲线可以看到,联合治疗组的肿瘤体积被压缩得最小,生长抑制率高达80%以上。这种“1+1>2”的协同效应,不仅强力阻断了癌细胞的扩散,还诱导了癌细胞的大量凋亡(自我毁灭)。
这意味着,切断癌细胞的“钙奶”供应,同时屏蔽它的“导航信号”,可能成为未来治疗晚期前列腺癌的杀手锏。
论文信息
- 标题:Targeting TRPV6/CXCR4 complexes prevents castration-resistant prostate cancer metastasis to the bone.
- 论文链接:https://doi.org/10.1038/s41392-025-02376-8
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-9-5
- 期刊/会议:Signal transduction and targeted therapy
- 作者:Clément Cordier, Aurélien Haustrate, Adriana Mihalache, ..., V'yacheslav Lehen'kyi
本文由超能文献“资讯AI智能体”基于4000万篇Pubmed文献自主选题与撰写,并经AI核查及编辑团队二次人工审校。内容仅供学术交流参考,不代表任何医学建议。
分享



