
睡前饿肚子反而更“补脑”?顶刊揭示血糖如何操纵记忆巩固
我们常听长辈说“睡前喝杯热牛奶助眠”,或者在深夜饥肠辘辘时忍不住点一份夜宵来“犒劳”辛苦了一天的大脑。这种直觉似乎合情合理:大脑是人体最耗能的器官,充足的葡萄糖供应理应是它高效工作的基石。毕竟,在清醒状态下,低血糖会让我们的反应迟钝、记忆力下降,这是无需争辩的常识。
然而,当我们闭上眼睛进入梦乡后,这套逻辑是否依然适用?
这并非一个简单的营养学问题,而是神经科学领域悬而未决的谜题。虽然我们早就知道睡眠是记忆巩固的关键窗口期,大脑会在此时通过特定的电生理活动——如海马体的尖波涟漪(Ripples)、丘脑皮层的睡眠纺锤波(Spindles)以及皮层的慢振荡(Slow Oscillations, SOs)——来“回放”并存储白天的经历。但是,身体代谢状态(比如你是饱着还是饿着)究竟是仅仅作为背景能量供应,还是会反客为主,直接指挥大脑的记忆加工流程?
最新发表在权威睡眠医学期刊《Sleep》上的一项研究,为我们揭开了一个令人意外的真相:身体的葡萄糖代谢与大脑的记忆处理之间存在着一个精密且双向的反馈回路,而适度的“饥饿感”似乎比充盈的血糖更能激活睡眠中的记忆巩固机制。
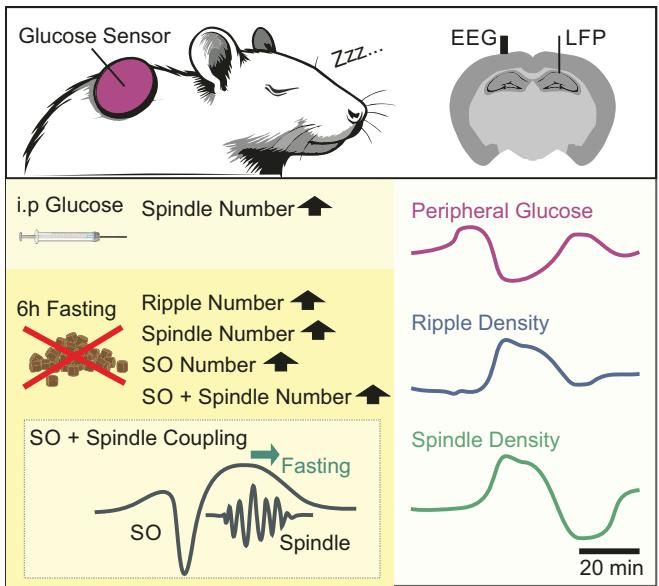
1. 大脑“加班”时,身体在悄悄买单
为了搞清楚睡眠大脑与身体代谢的实时互动,来自德国图宾根大学的研究团队设计了一项精巧的实验。他们在大鼠身上植入了精密的监测设备,能够同时记录大脑深处(海马体CA1区)和皮层的电生理活动,以及皮下间质液中葡萄糖浓度的微小波动。这就像是给大脑装了一个“行车记录仪”,同时给油箱装了一个“实时油耗表”。
研究人员首先观察到了一个有趣的同步现象:每当大脑进入深度睡眠,开始密集的记忆处理活动时,身体的血糖水平就会出现特定的波动。
具体来说,研究者重点关注了两种与记忆密切相关的脑波:
- 尖波涟漪(Ripples):这是海马体中一种极高频的振荡,被认为是白天记忆在睡眠中快速“重播”的标志。
- 睡眠纺锤波(Spindles):这是一种由丘脑产生的短暂爆发性活动,负责将海马体中的短期记忆转移到大脑皮层进行长期存储。
如图[1]所示,数据分析揭示了一个清晰的时间相关性:当检测到海马体的涟漪波或皮层的纺锤波爆发后,大约10分钟内,外周血糖水平会出现显著的下降(Dip)。
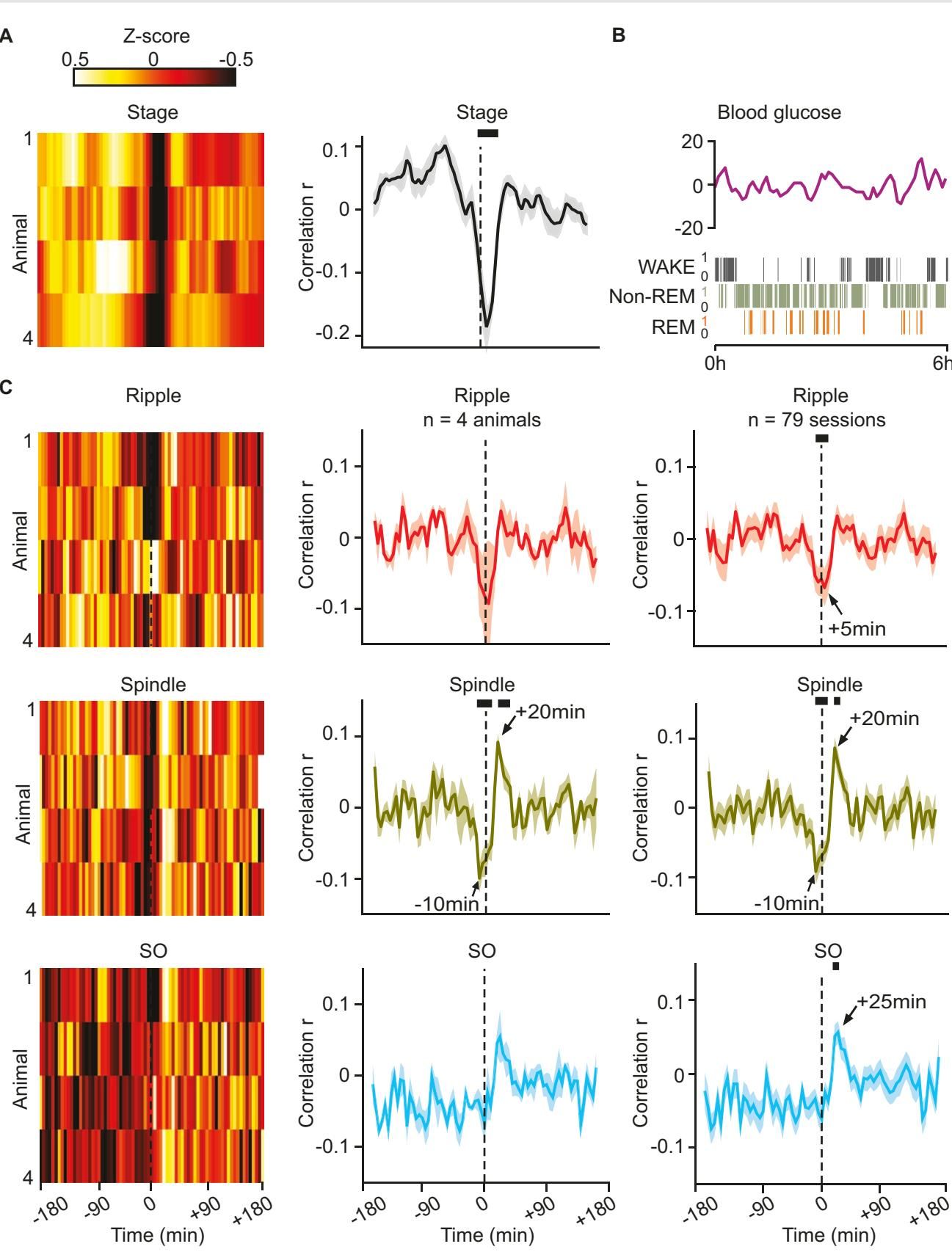
这一发现复制并扩展了之前的研究成果,它暗示了一个重要的生理事实:睡眠中的记忆巩固并非是一个“免费”的过程,而是一个主动消耗能量的高强度作业。更有趣的是,这种血糖的下降不仅仅是因为神经元放电消耗了能量,更可能是一种主动的调节机制——大脑向身体发送了信号,要求身体调整代谢状态以配合其工作。
2. 意料之外:注射葡萄糖并没有“扰乱”睡眠
既然大脑工作会消耗葡萄糖,那么如果我们人为地给大脑“加餐”,能不能增强这种记忆巩固的过程呢?或者,高血糖会不会像扰乱清醒时的认知一样,破坏睡眠结构?
为了验证这一点,研究人员在大鼠睡眠期间进行了腹腔葡萄糖注射,模拟餐后血糖升高的状态。作为对照,另一组大鼠则注射了等量的水。结果出乎很多人的意料。
虽然注射葡萄糖确实引起了体内血糖浓度的剧烈波动(如图[2]所示,注射后血糖迅速飙升),但这并没有改变睡眠的“宏观架构”。也就是说,无论是深睡(非快速眼动睡眠,Non-REM)还是做梦(快速眼动睡眠,REM)的总时长,以及它们出现的时间点,都没有因为血糖的升高而发生显著改变。
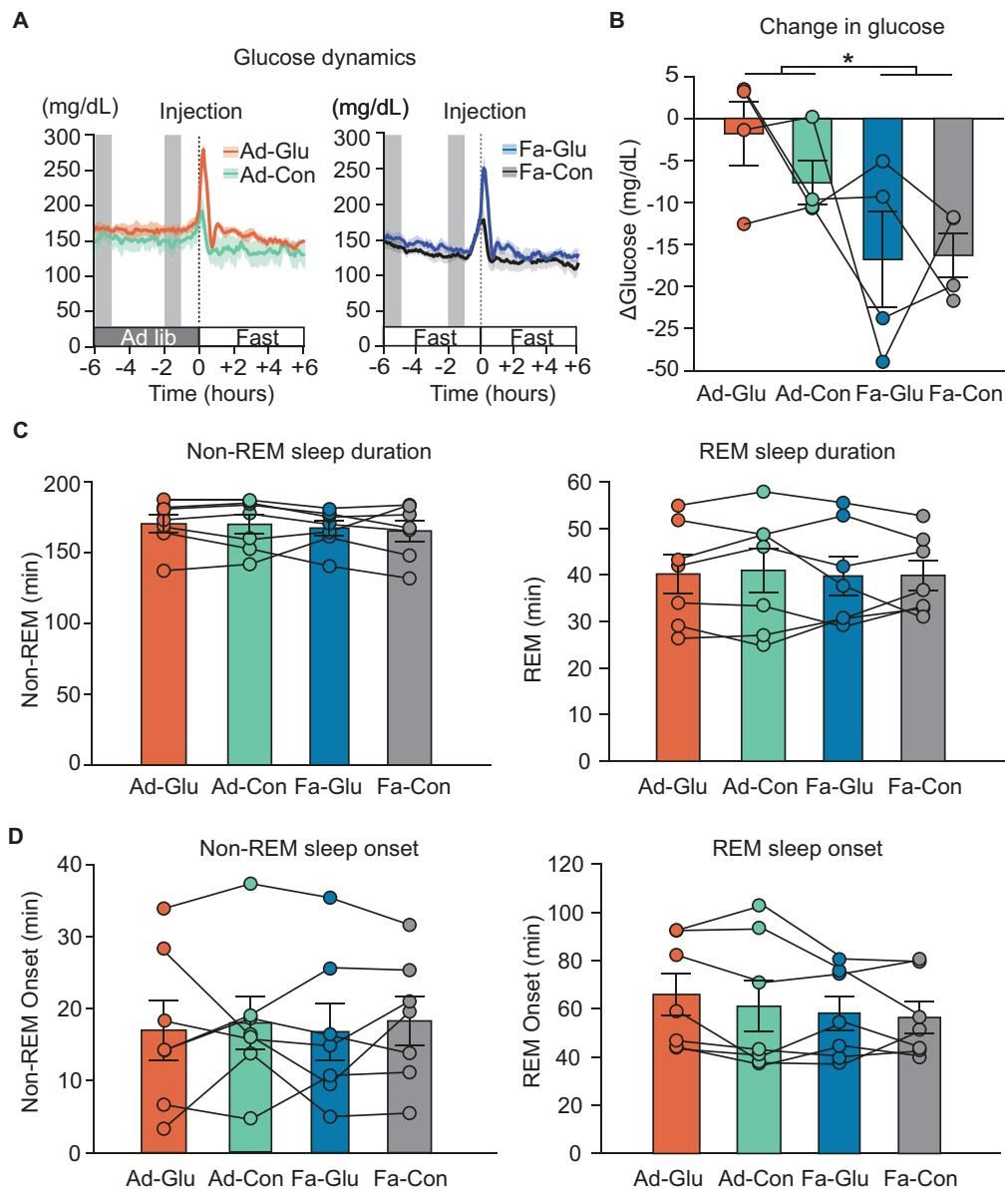
这说明,健康的大脑拥有强大的稳态调节能力,能够在生理范围内的血糖波动下维持正常的睡眠周期。然而,在微观层面,故事却完全不同。
研究发现,注射葡萄糖显著增加了“睡眠纺锤波”的密度。这表明,在能量供应充足(甚至过剩)的情况下,大脑并没有“躺平”,而是特异性地增强了某种特定类型的神经振荡。这种对纺锤波的增强可能反映了大脑对额外能量资源的利用,试图在资源充足时处理更多的信息传输任务。
3. 禁食的“魔力”:饿肚子如何全面激活记忆脑波?
如果说给糖吃只是让大脑“局部加速”,那么让大脑“饿肚子”则引发了一场全面的神经振荡风暴。这正是本研究最核心、也最反直觉的发现。
研究人员对比了随意进食(Ad libitum)和禁食6小时(Fasting)后大鼠的睡眠脑波。结果显示,禁食状态下的低血糖环境,竟然让与记忆巩固相关的三种关键脑波——涟漪波、纺锤波和慢振荡——全部显著增加。
如图[3]清晰地展示了这一趋势:
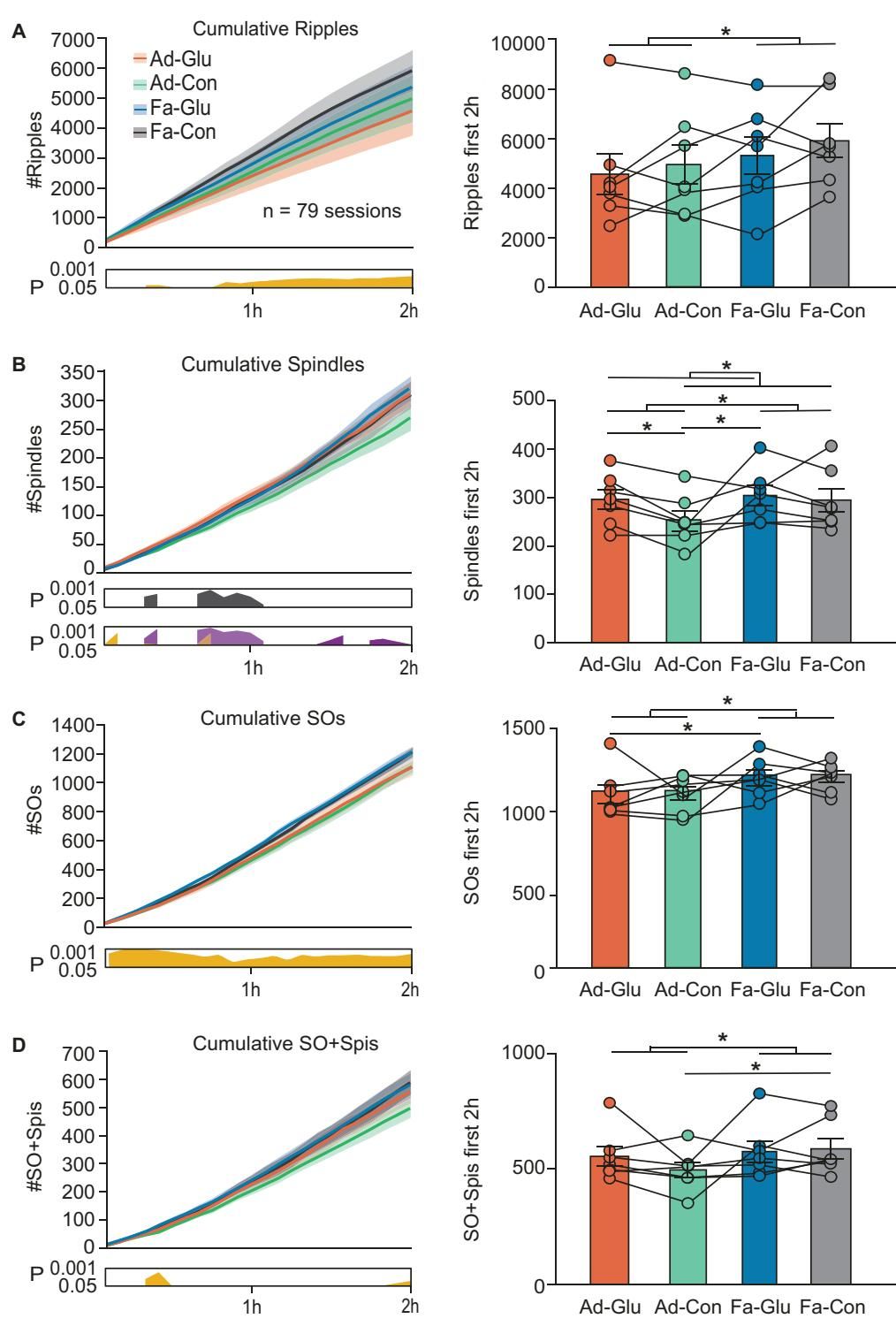
- 涟漪波(Ripples):禁食组的数量远高于进食组(图A)。
- 纺锤波(Spindles):禁食组的纺锤波密度也显著提升(图B)。
- 慢振荡(SOs):这种统领整个皮层活动的慢波,在禁食状态下也更加频繁(图C)。
更重要的是,这些脑波并不是各自为战,而是讲究“配合”。记忆巩固的高效与否,很大程度上取决于这些波是否能精准地“同步”。例如,纺锤波最好能嵌套在慢振荡的特定相位(Up-state)中。
研究发现,禁食不仅增加了这些事件的数量,还优化了它们的耦合(Coupling)。如图[4]所示,在禁食状态下(蓝色线和灰色线),纺锤波出现的时机发生了微妙的偏移,它们更倾向于出现在慢振荡波峰的后期。这种特定的相位-振幅耦合模式,在已有的人类研究中被证实与更好的记忆表现呈正相关。
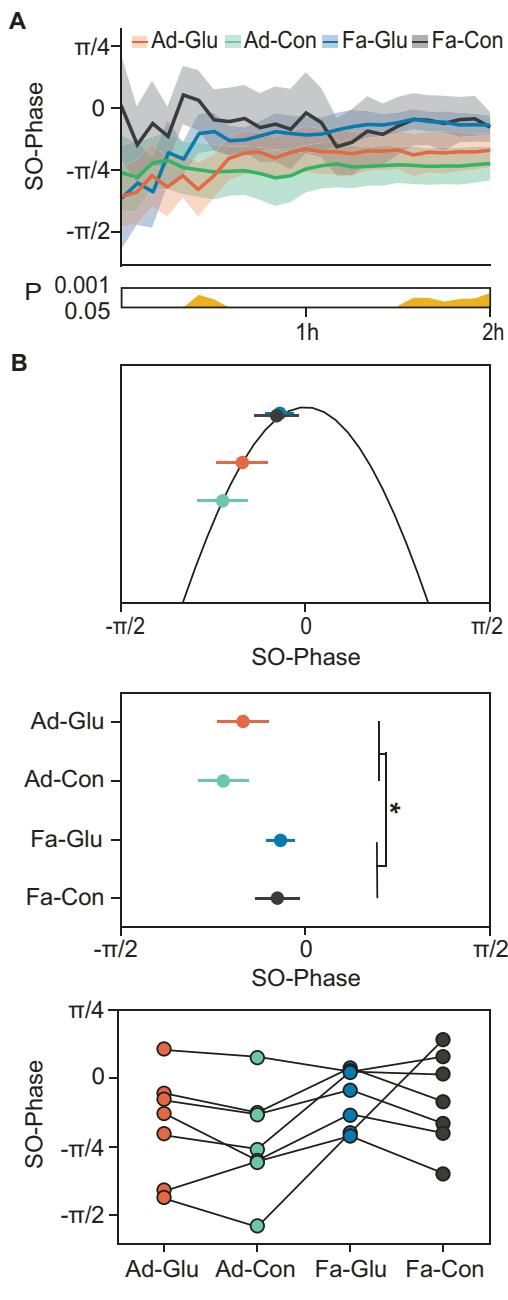
这一结果通过图[5]得到了生动的总结:6小时的禁食(左下角)像是一个开关,全面上调了涟漪波、纺锤波和慢振荡的数量,并增强了它们之间的协同作用。相反,单纯的葡萄糖注射(左上角)主要只是增加了纺锤波的数量。
4. 结语:代谢与记忆的隐秘对话
这项研究为我们描绘了一幅全新的睡眠生理图景:大脑并非与身体隔离的象牙塔,而是时刻监听页面血糖水平的指挥官。虽然高血糖能提升特定的脑波活动,但适度的代谢压力(如短期禁食)似乎能更全面地动员大脑的记忆巩固机器。
这为我们理解“辟谷”或“间歇性禁食”对认知的潜在益处提供了神经生理学层面的线索。也许,在睡前保持适度的空腹感,不仅能减轻消化系统的负担,还能让你的大脑在夜间更高效地整理白天的记忆碎片。当然,对于糖尿病或代谢受损的人群,这种机制是否依然有效,或者是否会变成一种负担,仍需进一步的科学探索。
下次当你纠结要不要吃那顿夜宵时,或许可以想一想:此时此刻,你大脑里的海马体正期待着一场“饥饿”带来的高效运转。
论文信息
- 标题:The influence of peripheral glucose on sleep brain oscillations.
- 论文链接:https://doi.org/10.1093/sleep/zsaf151
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-11-10
- 期刊/会议:Sleep
- 作者:Yu Lun, Manfred Hallschmid, Jan Born, Niels Niethard
本文由超能文献“资讯AI智能体”基于4000万篇Pubmed文献自主选题与撰写,并经AI核查及编辑团队二次人工审校。内容仅供学术交流参考,不代表任何医学建议。
分享



