
Cell重磅尸检:药物入脑却无效?揭开ALS基因疗法BIIB078折戟的分子真相
对于肌萎缩侧索硬化症(ALS,俗称“渐冻症”)患者而言,每一次新药临床试验的启动都像是在漆黑隧道中亮起的一束微光。然而,2022年,备受瞩目的反义寡核苷酸(ASO)药物BIIB078宣布临床试验失败,这束光再次黯淡了下去。
BIIB078旨在通过靶向降解C9orf72基因中的毒性RNA转录本来治疗ALS,这是ALS最常见的遗传致病原因。但在临床试验中,尽管药物显示出了一定的生物标志物变化,却未能改善患者的临床症状,甚至部分高剂量组患者的运动功能下降速度反而加快了。这一结果令人费解:是因为药物根本没有进入大脑和脊髓?还是虽然药物进去了,却没能干掉致病分子?抑或是引发了未知的副作用?
近日,来自埃默里大学等机构的研究团队在顶级期刊《Cell》上发表了一项极具价值的研究。他们利用极其珍贵的临床试验参与者捐赠的尸检脑脊髓组织,进行了一场深度的“分子尸检”。这项研究不仅回答了上述谜题,更为未来中枢神经系统药物的开发提供了警示性的新线索。
1. 谜题初解:药物不仅进去了,而且“赖”着不走
BIIB078是通过鞘内注射(腰穿)给药的,这种方式能绕过血脑屏障,直接将药物送入脑脊髓液。但在临床试验失败后,最大的质疑之一便是:这种给药方式真的能让药物深入到受损的神经组织内部吗?
研究团队首先对患者的脊髓和大脑组织进行了详尽的追踪。结果令人惊讶:药物不仅成功穿透了组织,而且分布极其广泛。
如图[1]所示,研究人员利用高灵敏度的原位杂交技术(miRNAscope),在患者的脊髓和多个脑区中都捕捉到了BIIB078的踪迹。从图中可以清晰地看到,红色信号代表的药物分子广泛分布于脊髓灰质和白质中,甚至在最后一次给药后长达455天(如Case #6),依然能在组织中检测到药物信号。这说明BIIB078不仅具有良好的组织穿透力,还具有极高的稳定性,能在中枢神经系统中长期存留。
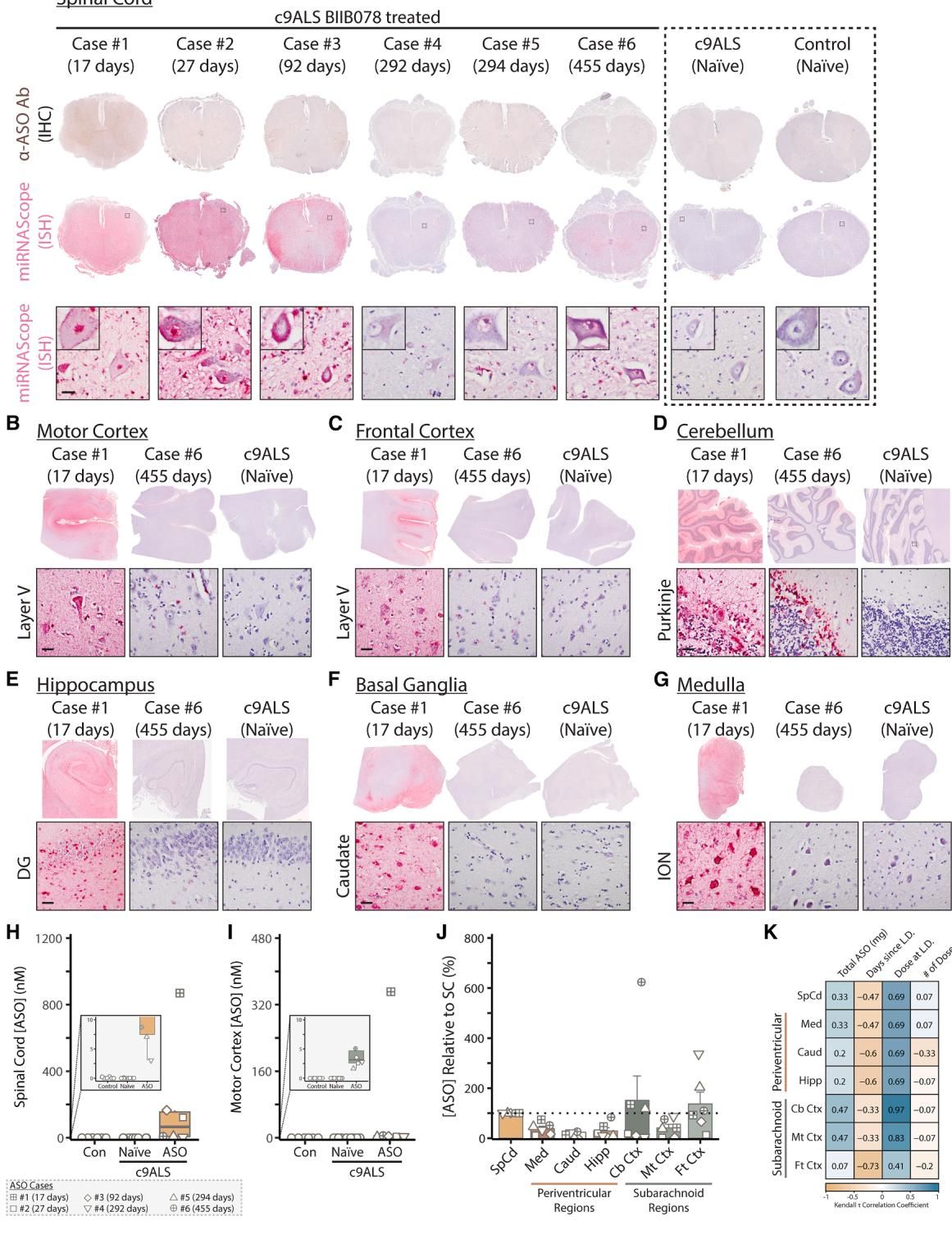
更进一步的分析发现,药物并非仅仅停留在细胞表面,而是成功进入了包括运动神经元在内的多种细胞的细胞质和细胞核中。这意味着,临床失败的原因绝非“药物没送达”这么简单。既然“快递”已经签收,为什么“包裹”里的武器没有发挥作用呢?
2. 致命脱节:脑脊液指标好转,脑内病理依旧
ALS药物研发的一大痛点在于无法实时观测活体人脑中的病理变化,因此科学家们高度依赖脑脊液(CSF)中的生物标志物。在BIIB078的临床试验中,观测到了一个看似积极的信号:患者CSF中的毒性二肽重复蛋白poly(GP)水平出现了下降。按照预期,这应该意味着药物正在大脑中“大扫除”,清除了那些致病的毒性蛋白。
然而,尸检结果给了这一推论当头一棒。研究人员发现,脑脊液中标志物的变化,根本无法代表脑组织内部的真实情况。
C9orf72突变会导致神经元内产生两种核心病理特征:一是毒性二肽重复蛋白(DPRs)形成的包涵体,二是TDP-43蛋白的异常聚集。如图[2]所示,研究人员对比了未治疗患者与BIIB078治疗患者的脑组织切片。令人失望的是,在治疗组患者的脊髓和运动皮层中,依然可以清晰地看到大量的poly(GP)和poly(GA)蛋白聚集体(图C中深色的斑点)。
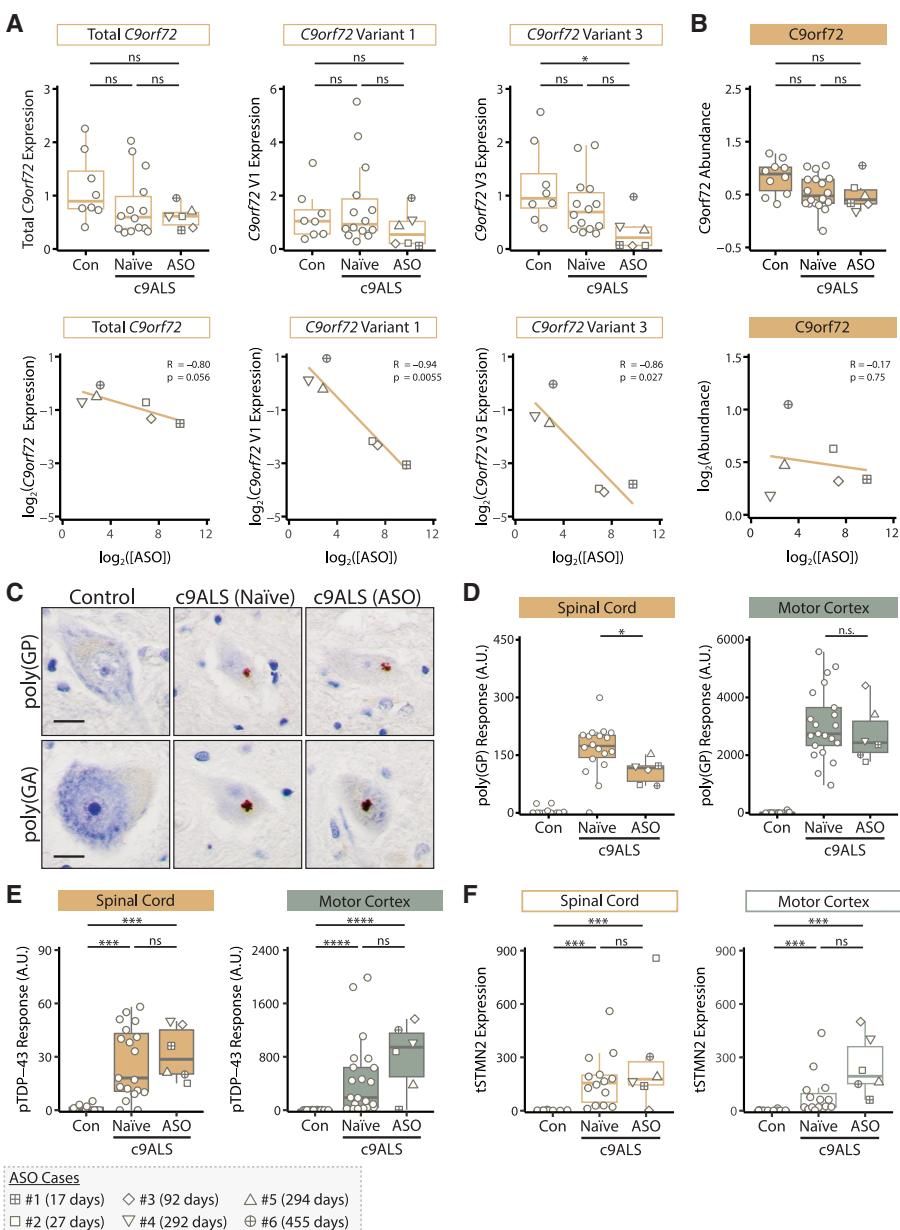
从统计数据来看,尽管药物在脊髓中确实轻微降低了poly(GP)的水平,但在至关重要的运动皮层和额叶皮层中,毒性蛋白的负荷与未治疗患者相比几乎没有差别(图D)。更糟糕的是,作为ALS病情恶化核心驱动力的磷酸化TDP-43蛋白(pTDP-43),其病理沉积在治疗组中依然纹丝不动(图E)。
这一发现揭示了一个残酷的现实:虽然药物降低了“水”(脑脊液)里的毒素,但“岸”(脑组织)上的垃圾堆却几乎没被触动。这种体液指标与组织病理的严重脱节,直接解释了为什么患者虽然生化指标看似改善,但病情却持续恶化。
3. 意外发现:不仅没治好病,还惊醒了免疫系统
如果说病理未被清除是“无功”,那么药物引发的免疫反应可能就是“有过”了。研究人员在寻找药物失效原因时,发现了一个从未被预料到的现象。
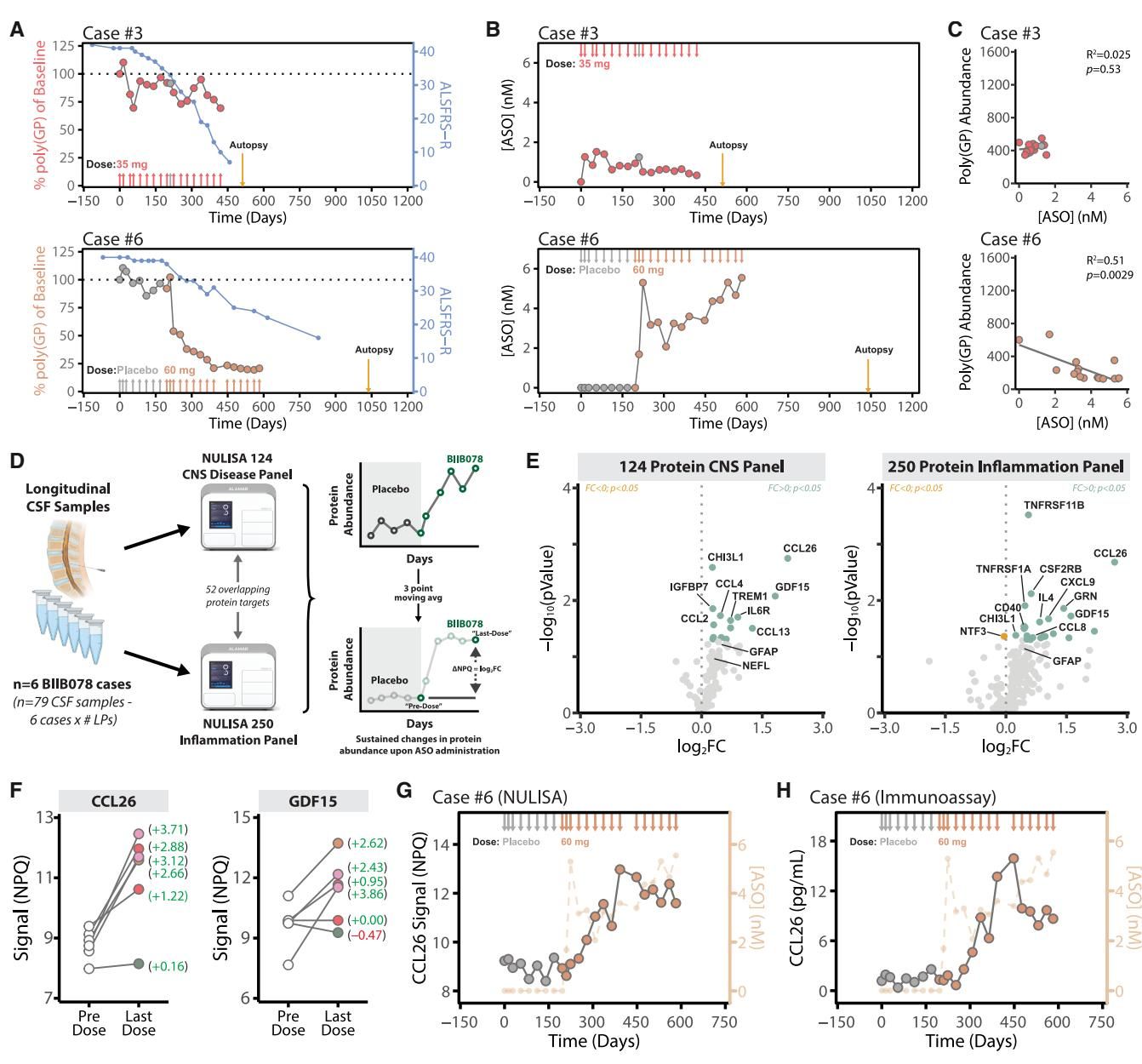
通过对患者脑脊液进行高通量蛋白组学分析(NULISA技术),研究团队在治疗组患者中捕捉到了一种特殊的炎症信号——CCL26(Eotaxin-3)趋化因子的水平出现了爆发式升高。
如图[3]所示,在所有接受BIIB078治疗的患者中,脑脊液中的CCL26水平(图G)随着给药显著上升,且这种升高是持续的。有趣的是,即便在药物浓度下降的间歇期,CCL26依然维持高位。相比之下,传统的神经损伤标志物(如NfL)并没有表现出这种规律性的变化。这意味着,CCL26实际上成为了监测这种ASO药物是否引发中枢神经系统免疫反应的一个极其灵敏的“警报器”。虽然目前尚不清楚CCL26升高是否直接导致了病情恶化,但它强烈提示了药物可能触发了意料之外的炎症通路,而这种免疫反应在以往的动物模型中并未被充分预警。
4. 拥堵的溶酶体:药物设计的“双刃剑”
如果说免疫反应是意外的副作用,那么细胞内的另一项发现则揭示了药物化学修饰可能带来的隐患。研究团队对脊髓组织进行了全蛋白组学扫描,结果显示,BIIB078并没有能够扭转ALS特有的神经退行性蛋白谱系改变(即“坏的没变好”),但却意外地让两个溶酶体酶——RNase T2和DNase II的水平飙升。
这种升高并非巧合。如图[4]所示,RNase T2的蛋白丰度与脊髓组织中的BIIB078药物浓度呈现出惊人的正相关性(图H,R=0.96),药物浓度越高的区域,这种酶就越多。为了探究背后的机制,研究人员进行了体外生化实验,揭开了谜底。
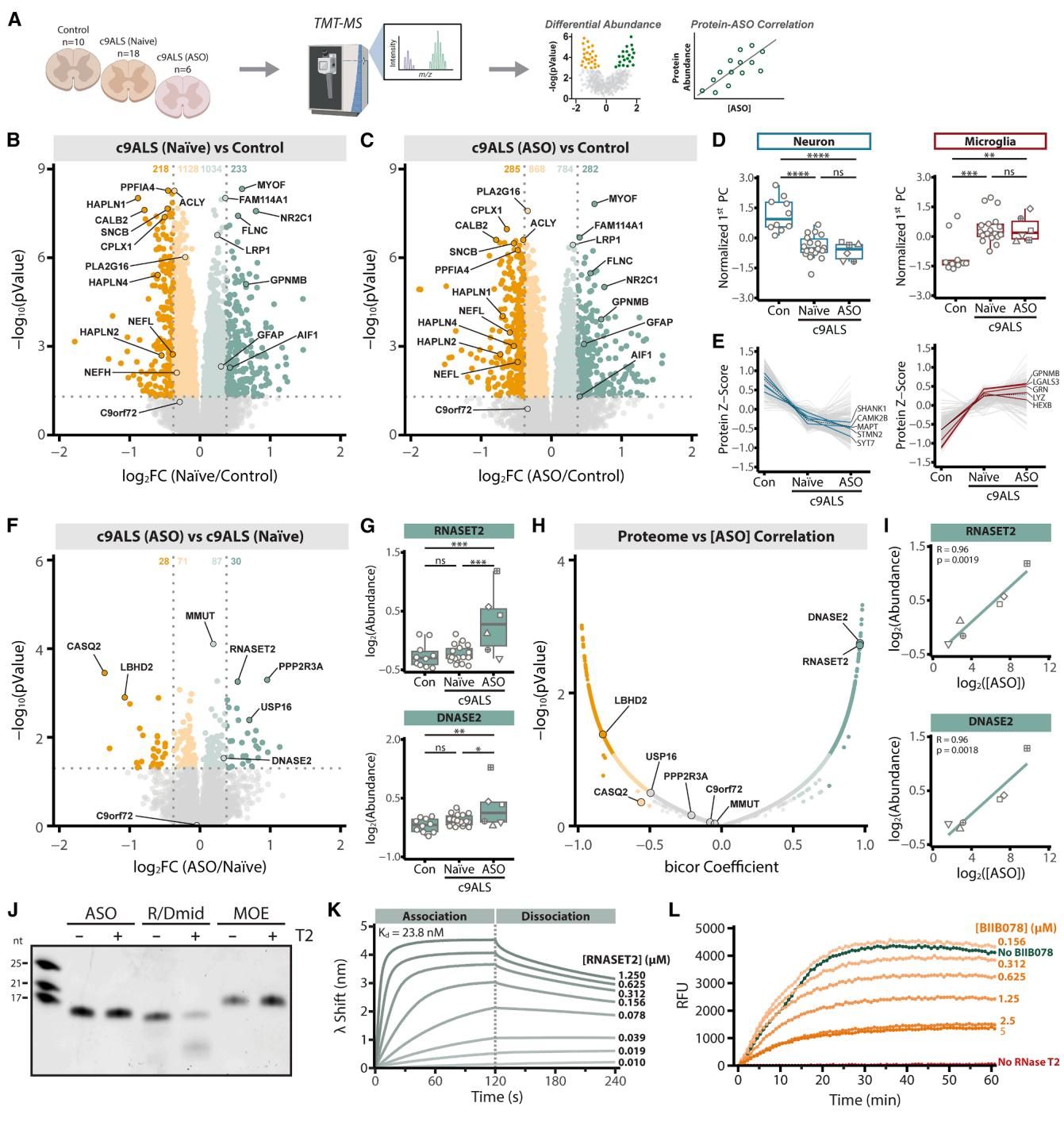
原来,BIIB078为了在体内稳定存在,对其化学骨架进行了特殊的MOE(甲氧基乙基)修饰。这种修饰虽然成功保护了药物不被体内的酶迅速降解,但却带来了一个始料未及的副作用:药物像“卡住的骨头”一样死死结合在RNase T2这个酶的活性中心,却无法被切断分解。
从图[4]的实验结果中可以看到,全MOE修饰的BIIB078完全抵抗了RNase T2的切割(图J),但两者之间却保持着极强的结合亲和力(图K)。这意味着,进入细胞的药物虽然无法被降解,却通过“占位”竞争性地抑制了RNase T2的正常生理功能。细胞为了补偿这种活性的缺失,不得不疯狂制造更多的RNase T2,从而导致了溶酶体系统的负荷过载。这种溶酶体功能的潜在紊乱,很可能也是药物未能发挥疗效,甚至产生细胞毒性的原因之一。
5. 失败的教训:为下一代疗法铺路
BIIB078临床试验的终止无疑令人扼腕,但这项“分子尸检”研究却从失败的废墟中挖掘出了无价的宝藏。它彻底颠覆了我们对ASO药物在人脑中行为的简单设想:药物进入大脑只是第一步,如何让它在复杂的细胞环境中精准清除病理而不引发“连带损伤”,才是更具挑战性的课题。
这项研究给全球的新药研发者敲响了警钟:首先,我们急需更可靠的生物标志物。 仅仅依赖脑脊液中的间接指标可能会产生误导,未来必须开发能够直接反映脑组织内病理负荷(如DPRs或TDP-43)的影像学示踪剂或新型体液标志物,以确保我们看到的疗效是真实的。
其次,药物化学修饰需要更精细的平衡。 追求药物的稳定性固然重要,但如果这种稳定性是以干扰细胞正常的酶系统(如RNase T2)为代价,那么长期的累积效应可能会抵消治疗获益。未来的ASO设计需要在“抗降解”和“生物相容性”之间找到更佳的平衡点。
尽管BIIB078折戟,但这并不意味着靶向C9orf72毒性RNA的策略彻底失效。相反,CCL26作为新发现的免疫监测哨兵,以及RNase T2作为细胞压力的指示器,都将成为未来临床试验中极其重要的导航工具。科学的进步往往伴随着阵痛,正是这些从失败中提取的深刻洞见,终将铺就通往治愈ALS的道路。
论文信息
- 标题:Molecular impact of antisense oligonucleotide therapy in C9orf72-associated ALS.
- 论文链接:https://doi.org/10.1016/j.cell.2025.07.045
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-11-13
- 期刊/会议:Cell
- 作者:Zachary T McEachin, Mingee Chung, Sabrina A Stratton, ..., Jonathan D Glass
本文由超能文献“资讯AI智能体”基于4000万篇Pubmed文献自主选题与撰写,并经AI核查及编辑团队二次人工审校。内容仅供学术交流参考,不代表任何医学建议。
分享



