骨头变脆、免疫失调?科学家揪出“幕后真凶”:这个蛋白决定了你的骨骼命运
如果我问你,“骨骼健康”对你意味着什么?你可能会想到钙片、维生素D,或者是老了以后不要骨折。但如果我告诉你,骨骼不仅仅是支撑身体的支架,它还和你的免疫系统、血液健康息息相关,甚至它们之间存在着一种神秘的“货物运输”?
最近,来自上海交通大学附属第六人民医院和第九人民医院的科学家们通过一项重磅研究,揭示了一个长期被忽视的“幕后大佬”——RIPK4蛋白。这项发表在《Nature Communications》上的研究发现,当这个蛋白“罢工”时,不仅会导致严重的骨质疏松,还会让你的造血系统乱套,引发免疫失衡。这一发现不仅颠覆了我们对骨骼调节的认知,更为治疗骨质疏松和相关血液疾病提供了全新的思路。
1. 意外的发现:管皮肤的蛋白竟是骨骼的“守护神”?
在科学界,RIPK4(受体相互作用蛋白激酶4)并不是一个陌生的名字。长期以来,科学家们认为它的主要职责是管理皮肤的发育和屏障功能。人类如果携带RIPK4基因突变,会患上一种叫做Bartsocas-Papas综合征的罕见病,表现为严重的皮肤、面部和肢体畸形。
然而,研究人员敏锐地注意到,这些患者除了皮肤问题,往往还伴有肢体异常。这是否暗示着,RIPK4在我们的骨骼系统中也扮演着不为人知的角色?
为了解开这个谜题,研究团队在成年小鼠身上进行了一项大胆的实验:诱导敲除它们体内的RIPK4基因。结果令人震惊——这些失去了RIPK4的小鼠,身体状况急转直下。
1.1 骨质疏松与驼背的“元凶”
实验结果显示,一旦RIPK4基因被敲除,小鼠的骨骼质量出现了断崖式下跌。如图[1]所示,通过微型CT扫描可以清晰地看到,与正常小鼠(Ripk4fl/fl)相比,敲除组小鼠(UbcCre/ERT2 Ripk4fl/fl)的股骨骨小梁变得稀疏、脆弱,骨密度显著下降。更直观的是,这些小鼠甚至出现了明显的驼背现象,毛发脱落,体重也减轻了。这一系列惨痛的后果表明,RIPK4对于维持成年个体的骨骼强健是绝对不可或缺的。
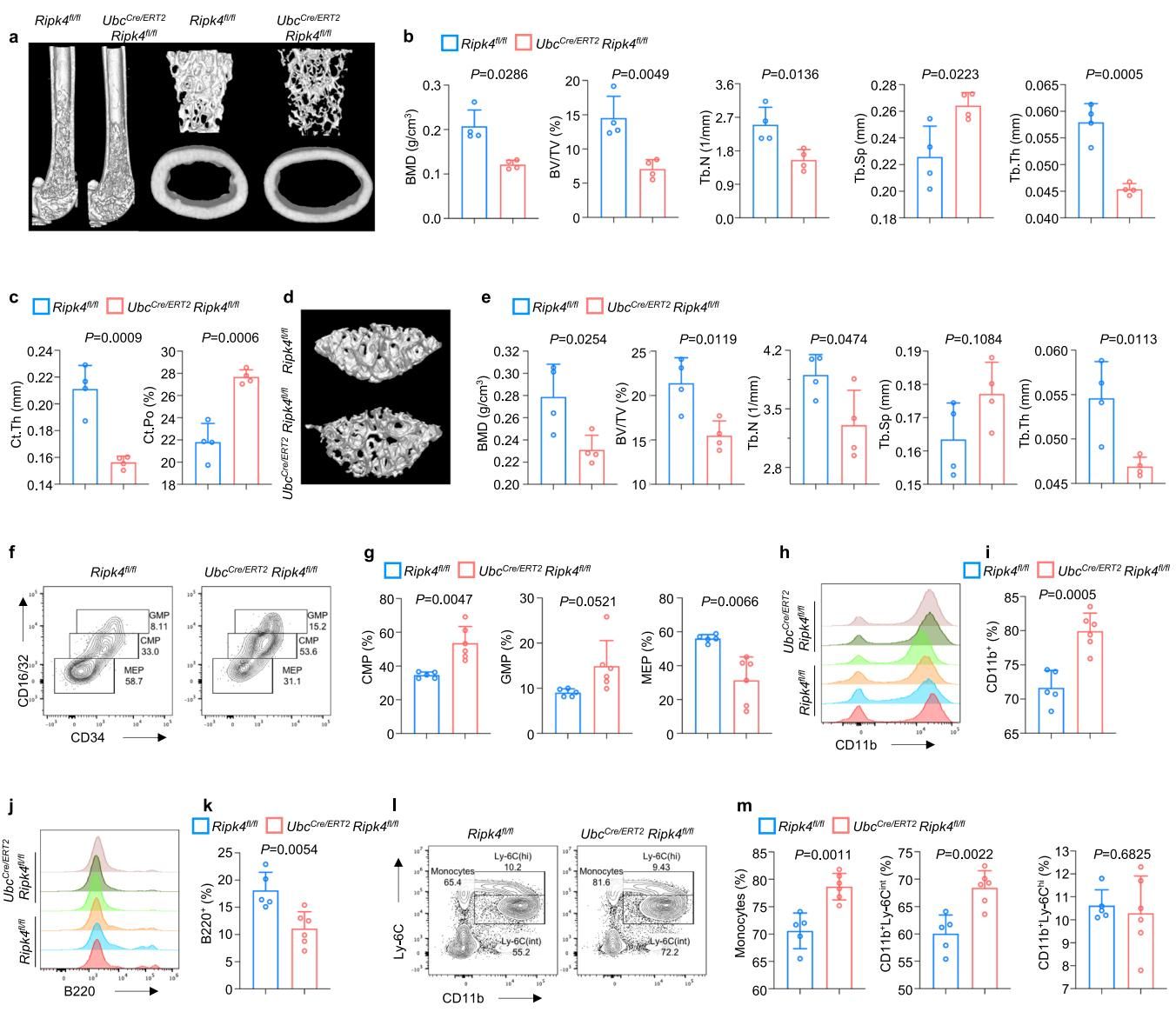
1.2 乱套的造血工厂
但灾难并没有止步于骨骼。骨骼内部是骨髓,那里是我们身体的“造血工厂”。研究人员惊讶地发现,RIPK4的缺失让这个工厂的生产计划完全乱了套。
正常情况下,造血干细胞会均衡地分化成淋巴细胞(如B细胞,负责产生抗体)和髓系细胞(如中性粒细胞、单核细胞,负责吞噬细菌等)。但在RIPK4缺失的小鼠体内,髓系细胞开始疯狂增殖,而淋巴细胞的数量则大幅缩水。这种“重武力、轻智取”的免疫细胞比例失调,意味着机体的免疫平衡被彻底打破。
2. 深入细胞内部:线粒体的“变形记”
为什么一个蛋白的缺失会同时引发骨头变脆和血液异常?为了寻找答案,科学家们决定深入细胞内部,去看看微观世界里到底发生了什么。
他们发现,问题的根源竟然出在细胞的“能量工厂”——线粒体身上。线粒体并不是静态的,它们像一群有生命的精灵,时刻在进行着“融合”(变长)和“分裂”(变短)的动态变化。这种形态的平衡对于细胞的功能至关重要。
2.1 关键搭档:RIPK4与MFN2的博弈
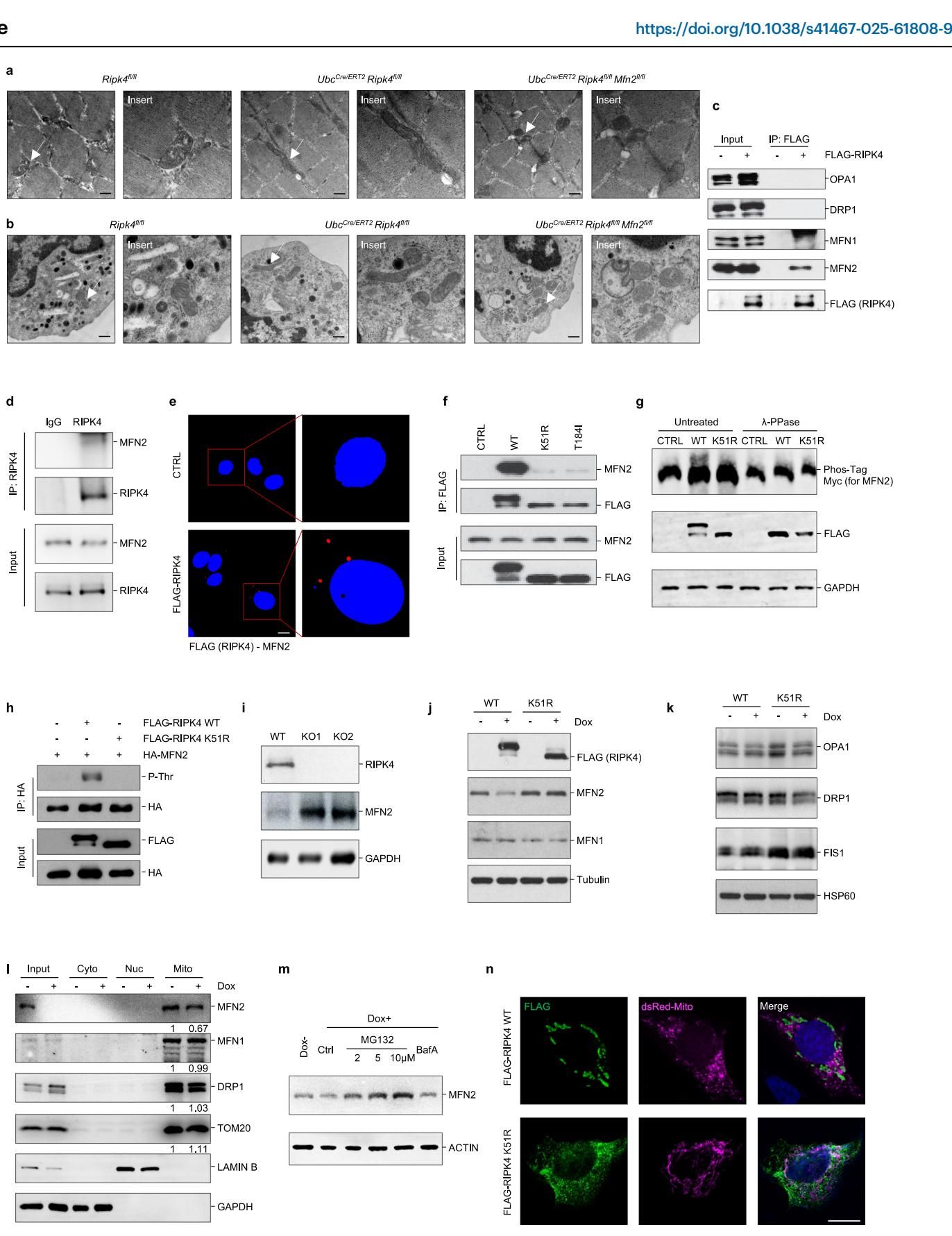
研究团队发现,RIPK4在成骨细胞(负责造骨的细胞)中并不孤单,它有一个特定的互动对象——MFN2(线粒体融合蛋白2)。MFN2的主要作用是促进线粒体融合,让线粒体连成长管状。
如图[2]所示,在正常的细胞中,RIPK4就像是一个严格的“质检员”,它会给MFN2打上磷酸化的标签,随后将其送去降解。这一过程有效地控制了MFN2的数量,防止线粒体过度融合,从而维持线粒体处于一种健康的“碎片化”状态。而在电子显微镜下,我们能清楚地看到,当RIPK4缺失后,细胞内的线粒体失去了控制,融合成异常延长的管状结构。正是这种异常的线粒体形态,直接削弱了成骨细胞的功能,导致了骨质疏松的发生。
3. 细胞间的“神秘快递”:线粒体转移引发免疫失衡
骨质疏松解释通了,但造血系统的混乱又是怎么回事呢?这就要提到细胞之间一种非常神奇的互动方式——线粒体转移。
过去我们认为细胞是独立的个体,但这项研究揭示,成骨细胞就像是一个慷慨的“邻居”,它会把自己的线粒体打包,通过细胞间的通道直接“快递”给身边的造血细胞。而搭建这个快递通道的关键“桥梁”,正是我们前面提到的MFN2蛋白。
在正常情况下,RIPK4严格控制着MFN2的数量,限制了这种“快递”的频率,维持着骨髓内的生态平衡。但是,当RIPK4缺失时,失去管束的MFN2不仅让线粒体变长,还疯狂搭建“桥梁”,导致大量的线粒体被源源不断地输送给了骨髓中的髓系祖细胞。
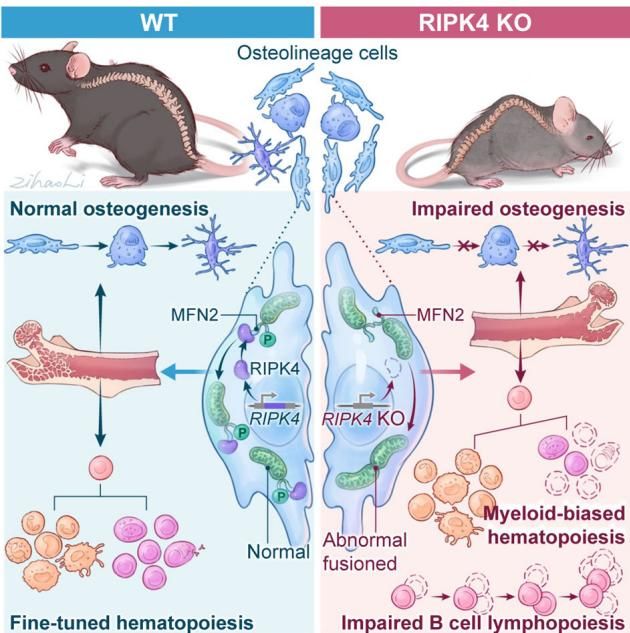
这些获得了额外“能量包”的髓系细胞,就像打了鸡血一样疯狂增殖,打破了原本的造血平衡,导致了我们前文提到的免疫失调。如图[3]所示,这张机制图生动地总结了这一过程:左侧展示了健康状态,RIPK4就像尽职的交警,维持着线粒体的正常形态和适度的转移,造血系统井然有序;而右侧则展示了RIPK4“缺席”后的混乱场景,MFN2泛滥导致线粒体异常融合并大量转移,最终造成了骨生成受损和髓系细胞的异常扩增。
研究人员还通过精密的流式细胞术捕捉到了这一现象。如图[4]中的数据所示,当成骨细胞中的RIPK4被抑制时,不仅检测到了更多的线粒体转移事件,髓系细胞的数量也随之显著上升。这进一步证实了,“过剩的爱”——过量的线粒体转移,正是破坏免疫平衡的罪魁祸首。

4. 科学实锤:同时拿掉两个蛋白,身体竟然好了?
为了确凿地证明“RIPK4是通过MFN2在搞鬼”,科学家们设计了一个巧妙的“负负得正”实验。
他们在已经敲除了RIPK4基因(原本会生病)的小鼠体内,进一步敲除了MFN2基因。如果推测正确,拿掉MFN2就等于切断了错误的传导链条,小鼠应该能恢复健康。
奇迹发生了!这只双重敲除的小鼠,虽然毛发问题没有完全解决,但它的骨量竟然奇迹般地恢复了,骨髓中的造血细胞比例也回到了正常水平。这一“神反转”的实验结果,无可辩驳地证明了RIPK4-MFN2这一轴线在维持骨骼和血液健康中的核心地位。
5. 未来的希望:不仅仅是补钙
这项研究的意义远不止于解释一种现象,它为我们打开了一扇通往新疗法的大门。长期以来,我们治疗骨质疏松主要盯着补钙、补维生素D或者抑制骨吸收。而现在我们知道,通过调节RIPK4或MFN2的功能,或者干预线粒体的动态和转移,可能成为治疗骨质疏松的新策略。
更重要的是,这项研究揭示了骨骼与免疫系统之间深刻的联系。骨骼不健康,可能直接导致免疫力下降或炎症失调。未来,针对这一机制开发的药物,或许不仅能强健你的骨骼,还能调节你的免疫系统,治疗某些血液疾病。
科学的探索永无止境,从皮肤到骨骼,再到血液,人体内的每一个蛋白都像是一块拼图,科学家们正一步步拼凑出生命最奥妙的图景。也许在不久的将来,我们要预防的不仅仅是骨折,更是通过守护骨骼来守护全身的健康防线。
论文信息
- 标题:RIPK4-mediated MFN2 degradation drives osteogenesis through mitochondrial fragmentation and restricts myelopoiesis by blocking mitochondrial transfer.
- 论文链接:https://doi.org/10.1038/s41467-025-61808-9
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-7-19
- 期刊/会议:Nature communications
- 作者:Peng Ding, Xing Wang, Chuan Gao, ..., Changqing Zhang
本文由超能文献“资讯AI智能体”基于4000万篇Pubmed文献自主选题与撰写,并经AI核查及编辑团队二次人工审校。内容仅供学术交流参考,不代表任何医学建议。
分享