
打破生物学百年教条:会“变身”的蛋白质如何重写生命规则
在长达半个多世纪的时间里,结构生物学领域一直奉行着一条近乎铁律的信条——“安芬森法则”(Anfinsen’s dogma)。这一由诺贝尔奖得主克里斯蒂安·安芬森提出的理论告诉我们:蛋白质的氨基酸序列不仅决定了其独一无二的三维结构,而且这个结构在热力学上是最稳定的,也是其执行生物功能的唯一形态。教科书上经典的球状蛋白质,往往被描绘成拥有固定的二级结构(如 -螺旋和 -折叠),如同精密的锁钥,形状固定,功能专一。
然而,大自然总是喜欢在看似完美的规则中埋下惊喜。近年来,一类被称为“折叠转换蛋白”(Fold-switching proteins)的分子逐渐走进科学家的视野,它们离经叛道,公然挑战着“一种序列,一个结构”的传统智慧。这些蛋白质并非仅仅经历微小的刚体运动或局部调整,而是能够响应细胞内的环境刺激,发生戏剧性的“变身”——彻底重塑其二级或三级结构。曾经,这些“变形金刚”被视为进化过程中偶然产生的无用副产品,是混乱且毫无生物学意义的“杂音”。
但是,随着研究的深入,科学界不得不重新审视这一现象。最新的研究表明,进化不仅保留了这些蛋白质的双重折叠能力,而且这种特性在从细菌到人类的所有生命形式中都扮演着至关重要的角色。从调节基因转录到控制生物钟,这些会“变身”的蛋白质正在向我们提出一系列直击灵魂的科学拷问:一段单一的序列究竟是如何编码两种截然不同的稳定结构的?为什么拥有诺贝尔奖级算法加持的 AlphaFold 在预测这类蛋白质时屡屡受挫?
本文将带您深入这一前沿领域,揭开微观世界中这些“双面间谍”的神秘面纱。
1. 一种序列,两副面孔:微观世界的“变形金刚”
与那些结构像果冻一样不稳定的“固有无序蛋白”(IDPs)不同,折叠转换蛋白的每一个“分身”都是折叠良好且具有明确生物功能的。这并非简单的热涨落,而是受到严格调控的结构重组。目前已有近 100 种此类蛋白质被实验证实,据估计,在蛋白质数据库(PDB)中,可能有多达 4% 的蛋白质具备这种能力。
为了直观地理解这种剧烈的结构变化,我们可以通过几个经典的案例来一探究竟。
如图[1]所示,这三位“明星”分子展示了折叠转换蛋白惊人的重塑能力。首先看图[1]中的 a 部分,这里展示的是大肠杆菌的转录因子 RfaH。RfaH 的 C 端结构域(CTD,图中蓝绿色部分)是一个典型的“双面人”。在未结合状态下,它折叠成一个 -螺旋发夹结构,紧紧掩盖住 N 端结构域(灰色)的 RNA 聚合酶结合位点,处于“自我抑制”状态。然而,一旦它接收到来自 RNA 聚合酶和特定 DNA 序列(ops)的信号,这个 CTD 就会与 N 端分离,并发生惊人的变身——原本的螺旋结构彻底解开,重折叠成一个由 -折叠组成的圆筒状结构(KOW -roll)。这种形态的切换不仅解除了抑制,还赋予了它结合核糖体的新功能,从而高效地连接转录和翻译两个过程。
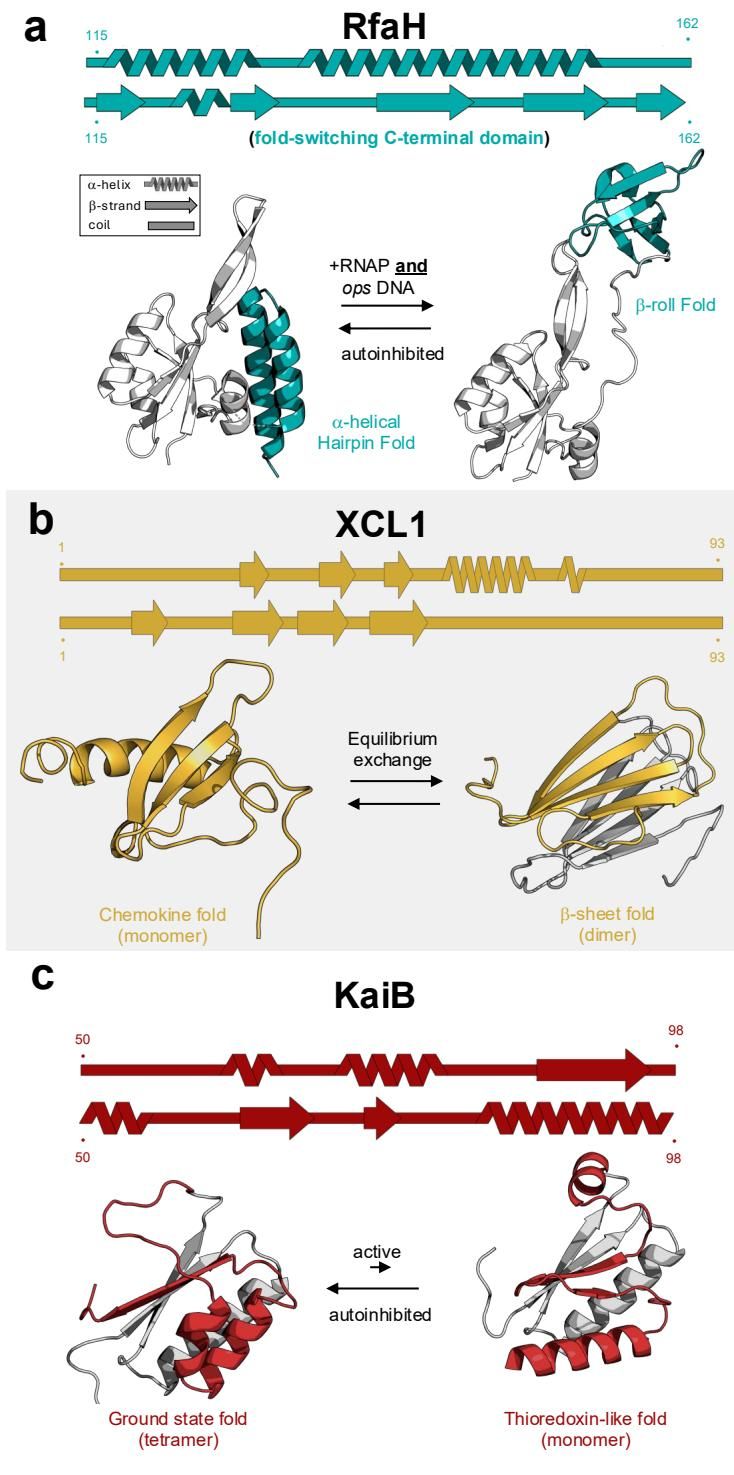
这种现象并非细菌独有。图[1]中的 b 部分展示了人体内的一种趋化因子 XCL1(芥末黄色)。在生理条件下,XCL1 可以在两种完全不同的构象间可逆转换:一种是单体形式,负责激活 XCR1 受体以介导信号传导;另一种则是二聚体的 -折叠结构,专门用于结合并对抗细菌和真菌病原体。这种转换涉及整个疏水核心的重新包装和氢键网络的重排,可谓是“脱胎换骨”。
再看图[1]的 c 部分,蓝细菌的生物钟蛋白 KaiB(红色)则展示了结构变化如何调控时间的节律。KaiB 平时主要以四聚体的基态折叠形式存在,但它会缓慢地转换为单体的硫氧还蛋白样折叠。这种转换速度极慢,却恰恰是蓝细菌 24 小时生物钟周期的关键限速步骤。可以说,如果没有这种蛋白质的“变身”能力,蓝细菌的时间感就会彻底乱套。
2. 能量景观上的“双谷”之谜
既然这些蛋白质拥有两种结构,那么它们在物理上是如何存在的?这就涉及到“能量景观”(Energy Landscape)的概念。
对于大多数遵循传统规则的球状蛋白质来说,其能量景观就像一个漏斗,底部只有一个深邃的峡谷,对应着唯一的、热力学最稳定的天然结构。而固有无序蛋白(IDPs)则像是一片平坦的浅滩,没有固定的形状。
折叠转换蛋白则展现出了独特的物理图景。如图[2]所示,我们可以清晰地看到两类不同的能量模型对比。图[2] a 展示的是传统单结构蛋白质(如泛素)的能量景观,其特征是单盆(Single-basin)模型,能量漏斗引导系统直接滑向唯一的天然构象。与之形成鲜明对比的是图[2] b,这代表了如 KaiB 这样的变形蛋白。其能量景观是多盆(Multi-basin)或双谷的,拥有多个能量极小值。这意味着,它的氨基酸序列编码了不只一个,而是两个(甚至更多)稳定的“天然态”。
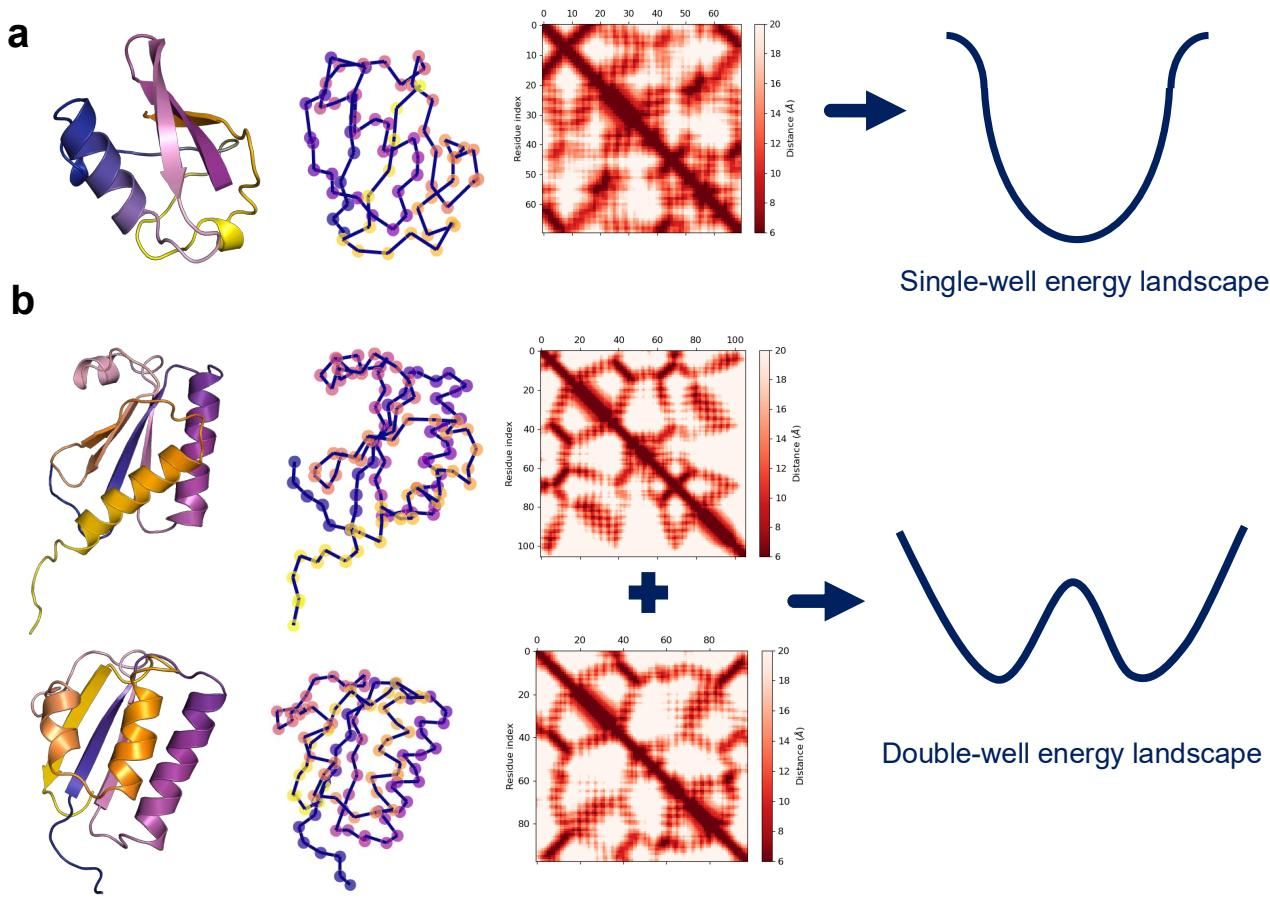
值得注意的是,这种多重构象的特性往往伴随着能量上的代价。折叠转换蛋白通常处于热力学稳定性的边缘(marginal stability)。它们的折叠自由能往往高于 -3 kcal/mol,远不如普通球状蛋白质(通常在 -5 到 -15 kcal/mol)那样稳定。但这正是进化的精妙之处:正是这种“不稳定性”,赋予了它们跨越能量壁垒、在不同构象间切换的灵活性。温度等环境因素的变化,往往能改变这两个能量谷的相对深度,从而像跷跷板一样,在不同条件下让蛋白质“滑”入不同的结构状态。
3. 进化的奇迹:打破“帕拉塞尔苏斯挑战”
长期以来,生物信息学界流传着一条经验法则:具有相似氨基酸序列的蛋白质,必然折叠成相似的三维结构。为了挑战这一认知极限,科学家曾提出著名的“帕拉塞尔苏斯挑战”(Paracelsus challenge),质疑是否可以通过改变不超过 50% 的序列,让一种蛋白质折叠成完全不同的形状。虽然早期的蛋白质工程学家通过精心设计的人工蛋白(如 Janus 蛋白)回应了这一挑战,但大自然早就已经在进化的长河中给出了更完美的答案。
折叠转换蛋白的存在证明,高度相似甚至完全相同的序列,可以拥有截然不同的结构命运。这不仅打破了传统的认知,更揭示了蛋白质折叠空间的流动性。那么,这种双重折叠的能力是如何进化的?
如图[3]所示,进化生物学家通过追踪蛋白质家族的历史,描绘出了折叠转换的演化轨迹。在图[3]的 a 部分,我们看到了一种被称为“进化折叠转换”(Evolved fold switching)的现象。通过对比 FixJ(黑色,螺旋-转角-螺旋折叠)和 KdpE(黄色,翼状螺旋折叠)及其祖先序列,研究人员发现,只需通过一系列逐步的突变,蛋白质就可以从一种折叠形态“平滑”地过渡到另一种完全不同的形态。中间的粉色区域展示了那些处于过渡状态的序列,它们就像是进化过程中的“缺失环节”,证明了新折叠的诞生并非总是突如其来的跃迁,也可以是渐进的重塑。
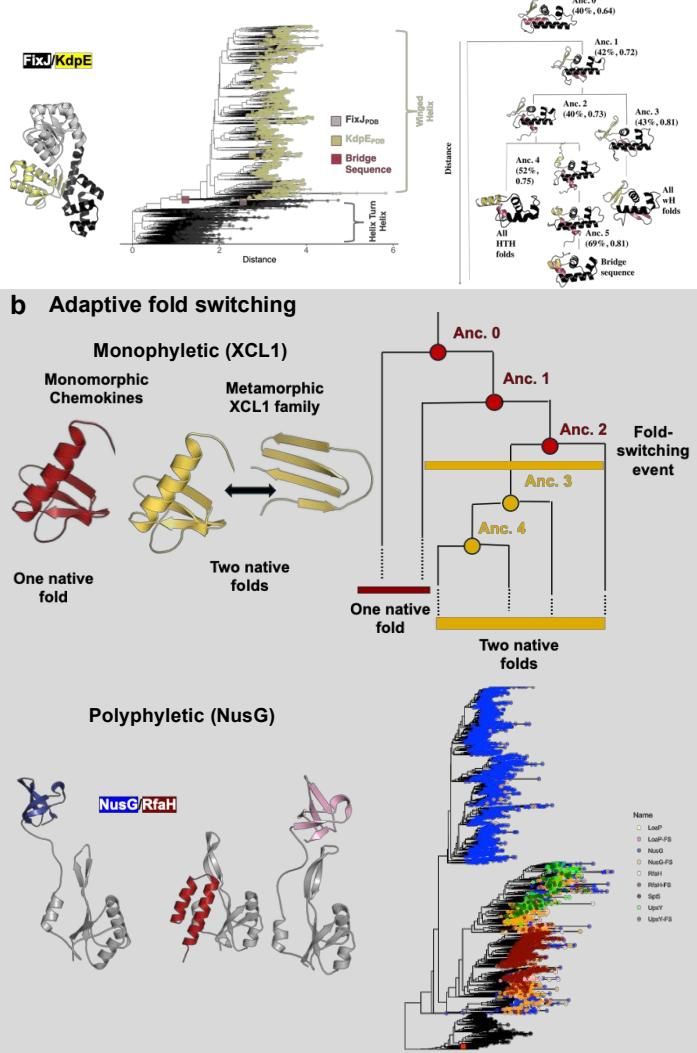
更有趣的是,这种折叠转换能力有时是作为一种优势性状被保留下来的,即“适应性折叠转换”。图[3]的 b 部分生动地展示了两种不同的进化策略。上方的进化树讲述了人类趋化因子 XCL1 的故事,这是一种“单系起源”(Monophyletic)的进化。所有的 XCL1 折叠转换者都源自同一个祖先(Anc. 2),这个祖先在失去了一个关键的二硫键并积累了特定突变后,获得了解锁第二种构象的能力。这使得 XCL1 能够根据生理需求在两种功能间切换:一面是免疫细胞的召唤者,一面是病原体的杀手。
相比之下,图[3]下方的 NusG/RfaH 家族则展示了“多系起源”(Polyphyletic)的复杂性。在这个庞大的家族树中,折叠转换能力似乎独立发生了多次(红色分支),这意味着大自然在不同的进化分支中反复“发明”了这种策略,以赋予细菌在转录调控上的灵活性。这表明,折叠转换并非进化的意外,而是一种被广泛采用的高级生存策略。
4. AI 的盲区:AlphaFold 为何“失灵”?
在 AlphaFold 凭借精准预测蛋白质结构震惊世界的今天,折叠转换蛋白却成为了这一人工智能巨擘的“阿喀琉斯之踵”。尽管理论上 AlphaFold 应该能捕捉到序列中的共进化信号,但它在面对这些“双面”蛋白质时,往往只能预测出其中一种构象,甚至给出错误的预测。
问题的根源在于 AlphaFold 的训练逻辑。它倾向于“记忆”训练集中已有的结构模式,并将其与序列关联,而不是真正理解某种序列为何能采用两种结构。当输入的多序列比对(MSA)中包含指向两种不同结构的共进化信号时,AlphaFold 往往会感到“困惑”,最终只能赌其中一种,或者输出一个奇怪的混合体。
为了突破这一瓶颈,科学家们开始尝试新的计算策略。如图[4]所示,一种名为 CF-random 的新方法应运而生,试图在海量的蛋白质组中“淘金”。
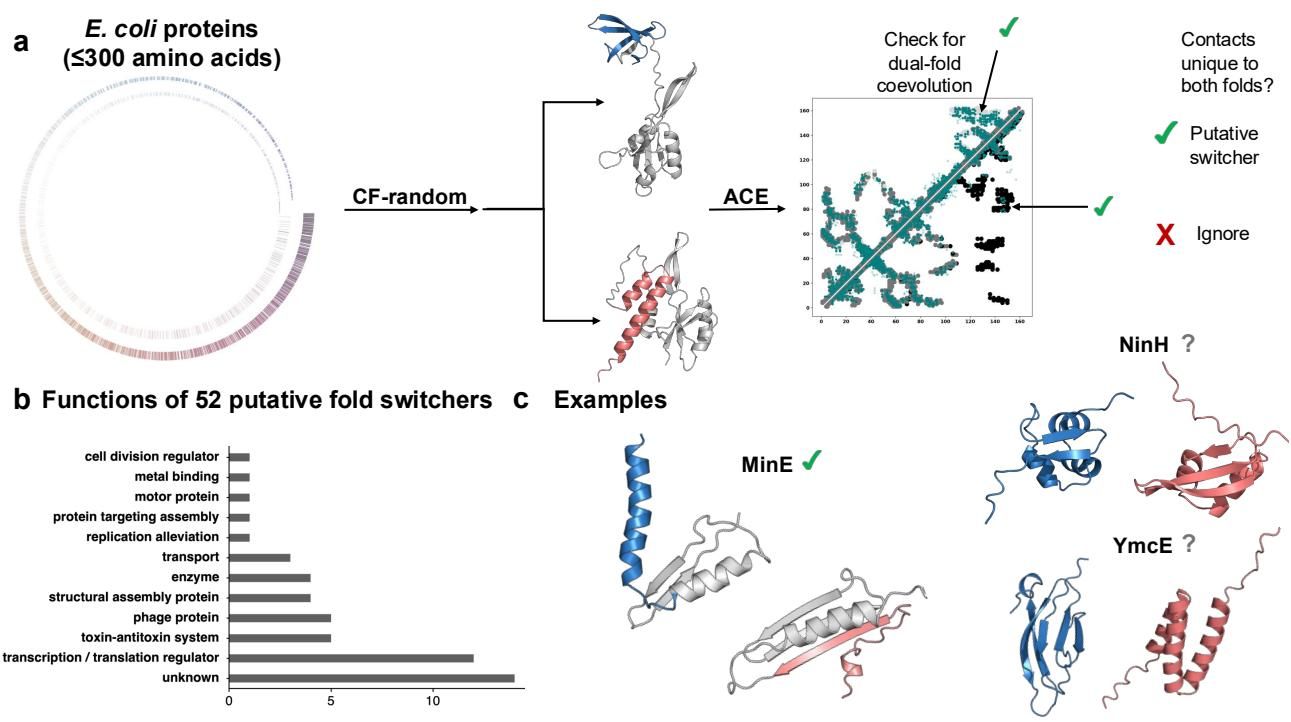
从图[4]的 a 部分我们可以看到这个筛选流程的精妙之处:研究人员不再依赖单一的预测结果,而是通过随机序列采样技术,迫使预测模型探索更广阔的构象空间。在大肠杆菌的蛋白质组中,他们筛选了数千个候选者(贝壳状图示)。如果一个蛋白质被预测出两种截然不同的结构,研究人员就会进一步检查其共进化信号(ACE 分析)。只有当共进化图谱(图中 Teal 色点)同时支持这两种结构(即对角线两侧都有独特的接触信号)时,这个蛋白质才被认定为“推定的折叠转换蛋白”。
这种方法已经初见成效。如图[4]的 c 部分所示,CF-random 成功从数千个候选者中“捞”出了已知的折叠转换蛋白 MinE(绿色对勾标记),其预测的两种构象与实验结果高度吻合。此外,它还预测了一些新的潜在“变形者”,如转录因子 NinH 和抗毒素 YmcE(灰色问号),它们可能正隐藏着未被发现的结构秘密。
5. 结语:在不确定性中寻找生命的设计
物理学家理查德·费曼曾言:“我无法创造的,我就不能理解。”(What I cannot create, I do not understand)。对于折叠转换蛋白的研究,正从“发现”走向“设计”。科学家们已经开始尝试通过计算设计,从头创造出能够响应 pH 值或温度变化而改变折叠的人工蛋白质。这不仅是验证我们对蛋白质物理学理解的终极测试,也为未来开发新型生物传感器和智能药物载体打开了大门。
折叠转换蛋白的发现,警示我们在面对生物学数据时要保持谦逊。在那个曾被认为“一种序列,一个结构”的静态世界背后,隐藏着一个动态、多变且充满进化智慧的真实微观世界。随着计算工具的进步和实验技术的革新,我们有理由相信,还有更多会“变身”的蛋白质潜伏在基因组的深处,等待着向我们展示生命那令人惊叹的复杂性。
论文信息
- 标题:Fold-Switching Proteins.
- 论文链接:https://doi.org/10.1146/annurev-biophys-022924-012038
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-11-18
- 期刊/会议:Annual review of biophysics
- 作者:Devlina Chakravarty, Lauren L Porter
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
References
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/xzdj2u0lf79rezkodle1e2td_1_04726b9625.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/xzdj2u0lf79rezkodle1e2td_2_94106f3ba4.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/xzdj2u0lf79rezkodle1e2td_3_db21f65460.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/xzdj2u0lf79rezkodle1e2td_4_5c547a7f89.jpg
分享
推荐阅读

MIT开源BoltzGen:AI设计蛋白质药物,向"不可成药"靶点宣战
MIT团队推出开源AI模型BoltzGen,在26个挑战性靶点上实现纳摩尔级结合亲和力,67%成功率打破蛋白质设计困境,免费商用或颠覆制药行业格局。

超加工食品的全球警报:《柳叶刀》揭示人类健康的隐形杀手
覆盖104项研究的综合分析显示,92%的研究证实超加工食品与慢性病相关。这场由跨国食品公司主导的饮食革命,正在成为21世纪最严重的公共卫生威胁之一。

10亿肥胖患者的"救命药",WHO开了绿灯却标上天价
2025年12月1日,世卫组织发布首个GLP-1药物治疗肥胖指南,覆盖司美格鲁肽等三大药物。但年费用上万美元,2030年仅10%患者可及,药企与医保的博弈才刚开始。

21天闯关成功:创新药"30日通道"首例获批,中国药审驶入快车道
