
胖也分来源?Nature子刊:动物脂肪比植物脂肪更易导致抗癌免疫“瘫痪”
“肥胖会增加患癌风险”,这似乎已是现代医学的一条铁律。流行病学数据明确显示,肥胖至少与13种癌症的风险增加有关,并且会提高癌症相关的死亡率。在公众和医学界的普遍认知中,过量的脂肪组织本身——无论其来源如何——都会通过慢性炎症、胰岛素抵抗等机制为肿瘤的生长提供温床。
然而,事实真的如此简单吗?是否每一公斤因饮食导致的体重增加,都对免疫系统有着同样的破坏力?
哈佛医学院与都柏林三一学院的跨国研究团队在顶刊《Nature Metabolism》上发表的一项最新研究给出了令人意外的答案。研究人员发现,导致肥胖的“脂肪来源”比“肥胖本身”更能决定肿瘤的命运。在一项针对黑色素瘤小鼠模型的严谨对照实验中,他们揭示了一个反直觉的现象:同样是诱导至同等程度的肥胖,摄入动物脂肪(如黄油、猪油)会显著加速肿瘤生长并瘫痪抗癌免疫,而摄入植物脂肪(如棕榈油、椰子油、橄榄油)则不会产生这种恶果。
这项研究不仅挑战了我们对“肥胖致癌”的单一化理解,更为通过膳食干预辅助癌症治疗提供了全新的精确靶点。
1. 颠覆认知:同等肥胖,截然不同的肿瘤结局
为了解开饮食脂肪成分与肿瘤生长之间的秘密关联,研究团队设计了一项规模庞大的平行对照实验。他们给小鼠喂食了多种不同来源的高脂饮食(HFD,45%的热量来自脂肪),包括经典的动物脂肪(猪油、牛油、黄油)和植物脂肪(椰子油、橄榄油、棕榈油)。
实验结果令人震惊。如图[1]所示,研究人员详细记录了小鼠的体重和肿瘤生长曲线。无论是吃猪油还是棕榈油,小鼠们都“如愿以偿”地变得同样肥胖,体重增长曲线几乎重合。然而,当植入B16-F10黑色素瘤细胞后,命运的分野出现了:
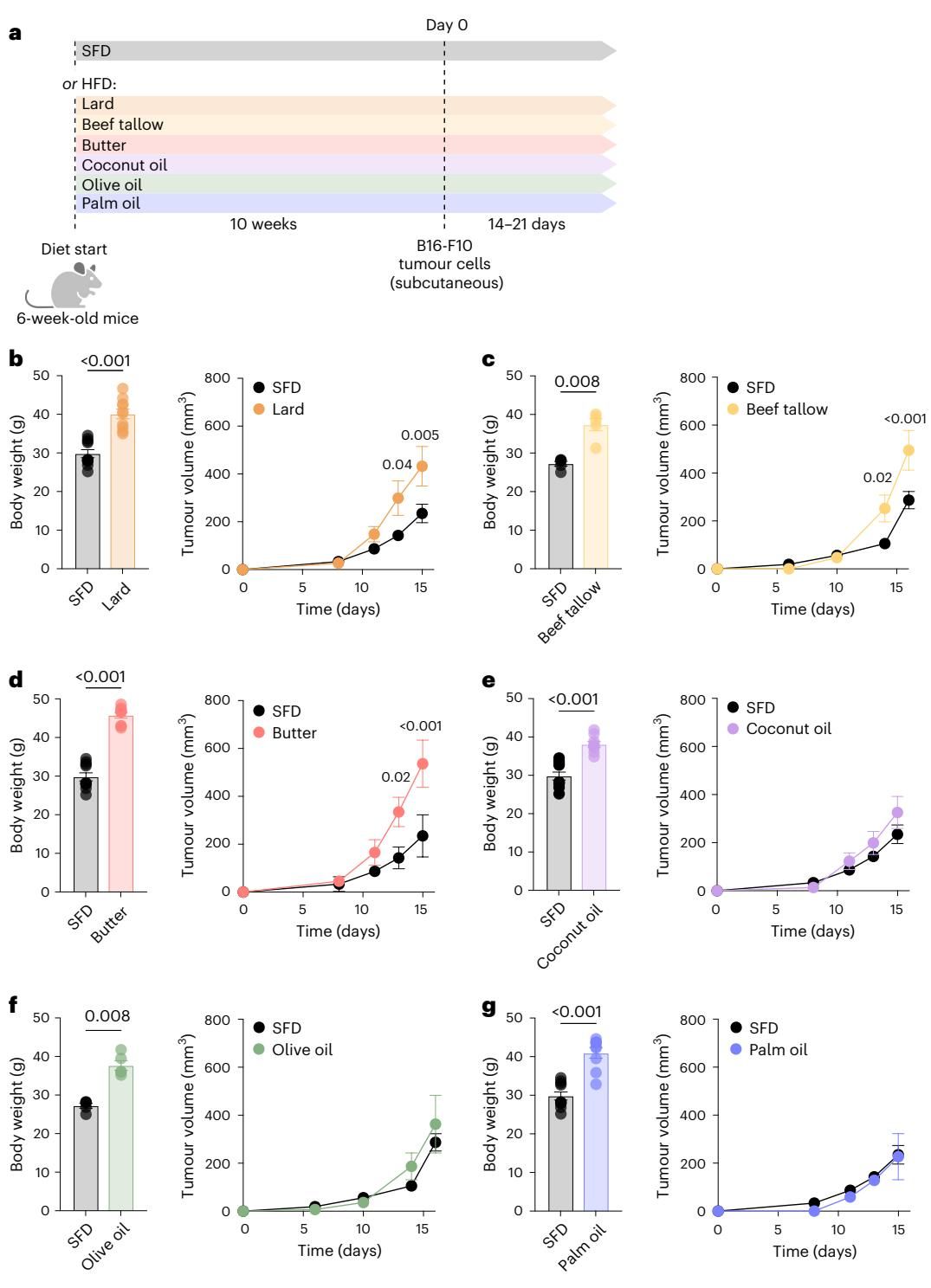
- 动物脂肪组(如猪油、牛油、黄油):肿瘤生长速度显著加快,甚至比普通饮食组还要迅猛。从图[1]b-d的右侧图表中可以清晰地看到,橘红色系线条代表的动物脂肪组,其肿瘤体积在接种后两周内急剧飙升。
- 植物脂肪组(如椰子油、橄榄油、棕榈油):尽管小鼠同样肥胖,但其肿瘤生长速度并没有显著增加,与普通饮食(SFD)组差异不大(图[1]e-g)。
这一发现直接打破了“肥胖即促癌”的刻板印象。它表明,在高脂饮食诱导的肥胖模型中,肿瘤的生长动力可以与肥胖程度“解绑”,而主要受控于膳食脂肪的具体类型。
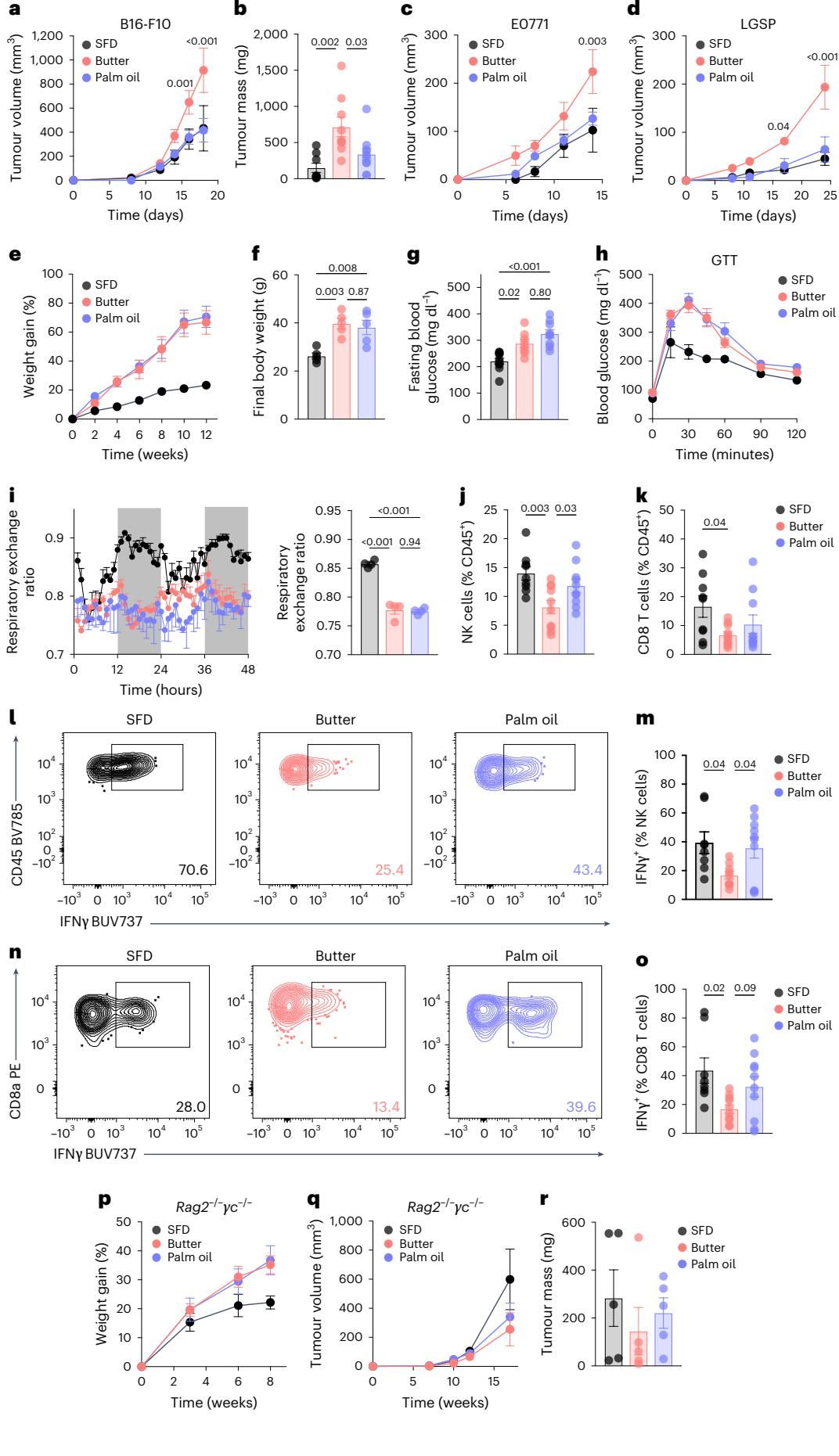
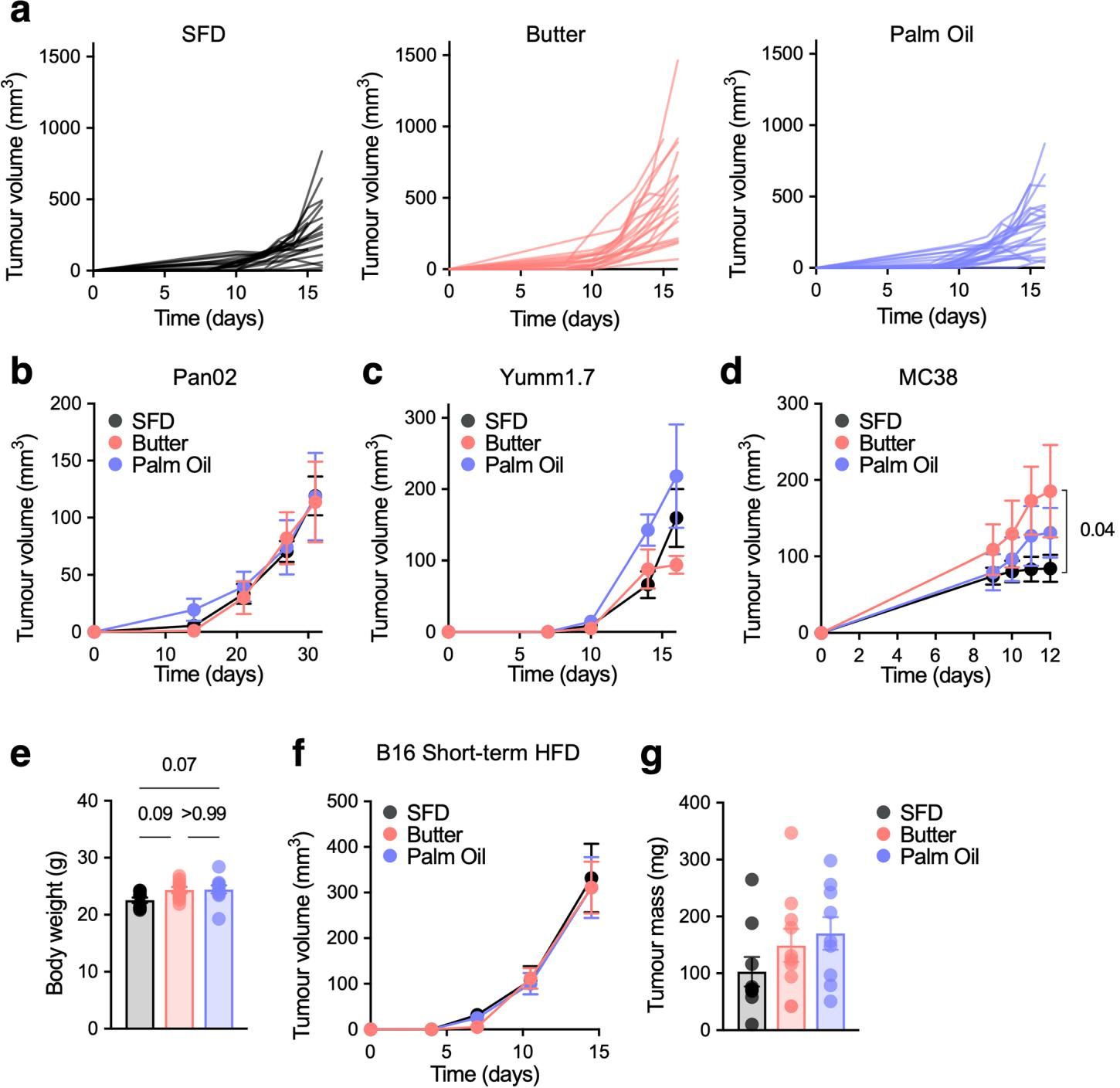
为了排除偶然性,研究人员进一步聚焦于差异最显著的两组——黄油高脂饮食(Butter-HFD)与棕榈油高脂饮食(Palm oil-HFD)进行深入对比。结果在多种肿瘤模型中得到了验证:如图[2]c-d所示,在乳腺癌(E0771)和肺癌(LGSP)模型中,黄油组的肿瘤生长依然“一骑绝尘”,而棕榈油组则表现温和,与普通饮食组无异。更有趣的是,这种饮食带来的差异必须建立在长期喂养导致的肥胖基础之上,如果仅仅短期喂食一周高脂饮食,不同脂肪来源对肿瘤生长的影响就会消失(图[3]f-g)。
2. 免疫防线溃败:黄油“瘫痪”杀手细胞,棕榈油“保全”战力
如果全身的新陈代谢水平(如血糖、胰岛素、血脂)没有显著差异,那么导致肿瘤生长天壤之别的“幕后推手”究竟是谁?答案指向了人体内的“抗癌特种部队”——免疫系统。
研究团队深入分析了肿瘤微环境,发现膳食脂肪的来源直接重塑了免疫细胞的战场表现。在黄油组小鼠的肿瘤中,作为抗癌主力的自然杀伤细胞(NK细胞)和CD8+ T细胞不仅数量稀少,而且战斗力极其低下——它们分泌干扰素-γ(IFNγ,一种关键的抗癌细胞因子)的能力大幅下降。相比之下,摄入棕榈油的小鼠虽然也同样肥胖,但其体内的NK细胞却依然保持着旺盛的战斗力和较高的浸润密度。
如图[2]所示,流式细胞术的数据直观地展示了这种差异:黄油组(红色数据点)肿瘤内的NK细胞和CD8 T细胞频率显著低于普通饮食组,而棕榈油组(蓝色数据点)的NK细胞频率则明显更高,且其产生IFNγ的能力(图[2]m, o)也并未受到肥胖环境的显著抑制。为了确证免疫系统在其中的决定性作用,研究人员使用了一种缺乏T细胞和NK细胞的免疫缺陷小鼠(Rag2-/- γc-/-)重复了实验。结果令人信服:一旦失去了这道免疫防线,无论吃黄油还是棕榈油,肿瘤的生长速度都变得一样快(图[2]p-r)。这强有力地证明,不同脂肪源对肿瘤的影响,正是通过调节免疫系统的功能来实现的。
2.1 NK细胞的“代谢瘫痪”与c-Myc的保护机制
深入到细胞内部,研究人员揭示了更为微观的机制。在黄油饮食诱导的肥胖环境中,NK细胞仿佛“吃撑了”——它们内部积累了大量的脂滴,导致细胞陷入了一种“代谢瘫痪”状态。这种状态下,NK细胞无法有效启动糖酵解和氧化磷酸化,也就失去了杀伤肿瘤所需的能量供应。
然而,棕榈油饮食却意外地触发了一种保护机制。如图[4]所示,通过蛋白质组学和代谢流分析,研究人员发现棕榈油组的NK细胞并没有出现严重的脂滴堆积(图[4]a-b),其代谢活性(ECAR和OCR指标)反而比黄油组更接近健康水平(图[4]c-h)。
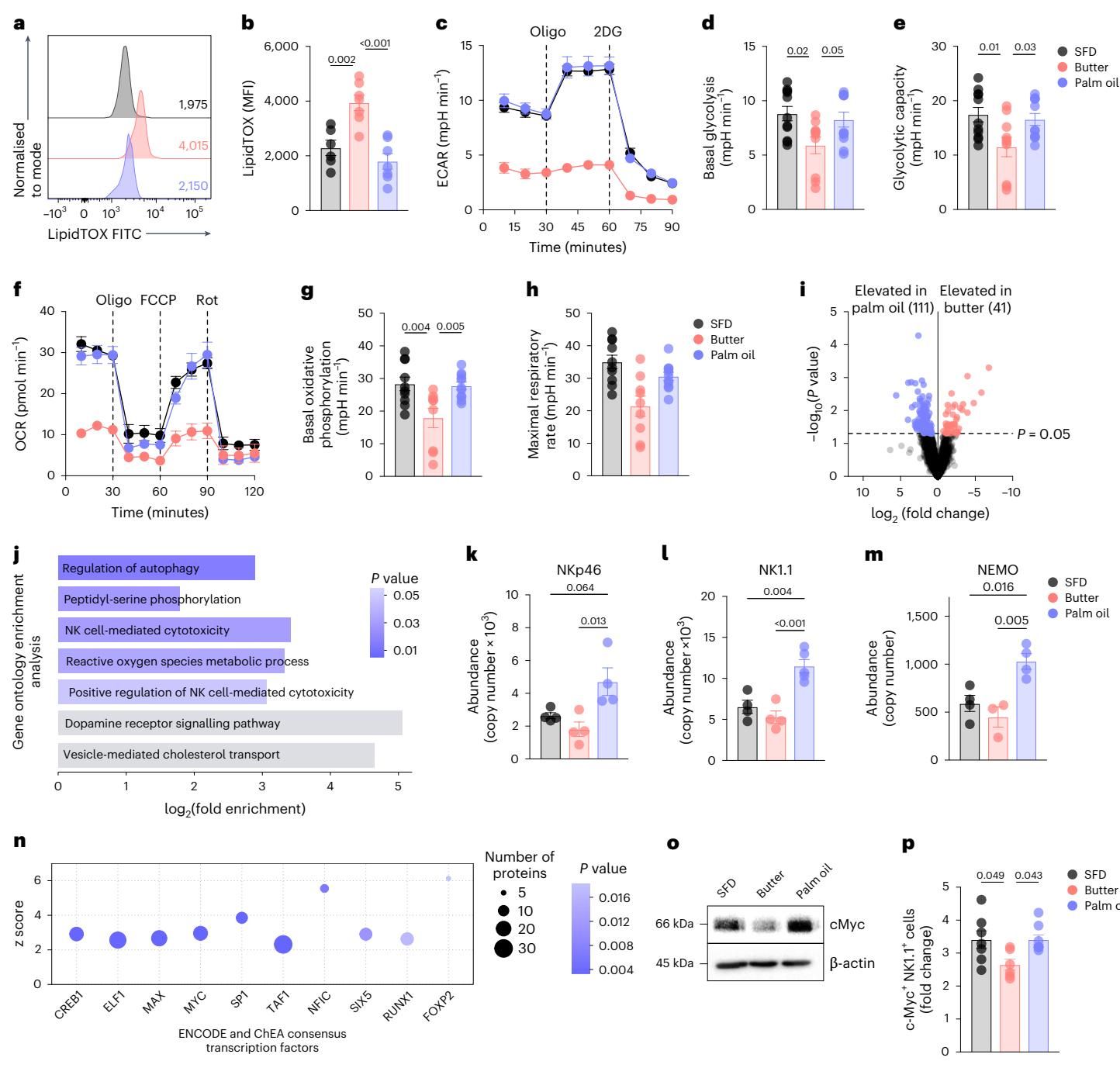
进一步的分析锁定了一个关键的转录因子——c-Myc。这是一种调控细胞代谢和生长的“总开关”。在棕榈油饮食环境下,NK细胞内的c-Myc表达被成功激活并维持在高水平,从而驱动了代谢程序的正常运转,防止了细胞因肥胖而“死机”。而黄油饮食则未能维持c-Myc的活性,导致NK细胞在面对肿瘤时显得力不从心。
3. 血浆中的隐形“毒药”:长链酰基肉碱 CAR18:0
如果说NK细胞是因为“暴饮暴食”而导致功能瘫痪,那么CD8+ T细胞的遭遇则更像是中了“慢性毒药”。研究人员惊讶地发现,与NK细胞不同,黄油组小鼠体内的CD8+ T细胞并没有在细胞内囤积过量的脂滴。为了解开其功能受损之谜,研究团队将目光投向了血液循环中流动的代谢产物。
通过对小鼠血浆进行高精度的代谢组学分析,一个关键的差异代谢物浮出水面——硬脂酰肉碱(Stearoyl-carnitine, CAR18:0)。如图[5]所示,代谢图谱清晰地展示了这种长链酰基肉碱在黄油饮食组小鼠体内的水平异常升高(图[5]c-e),显著高于棕榈油组和普通饮食组。这一现象与膳食本身的脂肪酸构成形成了完美的互证:黄油富含硬脂酸(C18:0),而棕榈油则以棕榈酸(C16:0)和油酸(C18:1)为主。摄入过多的硬脂酸,直接导致了体内CAR18:0这种中间代谢产物的病理性积聚。
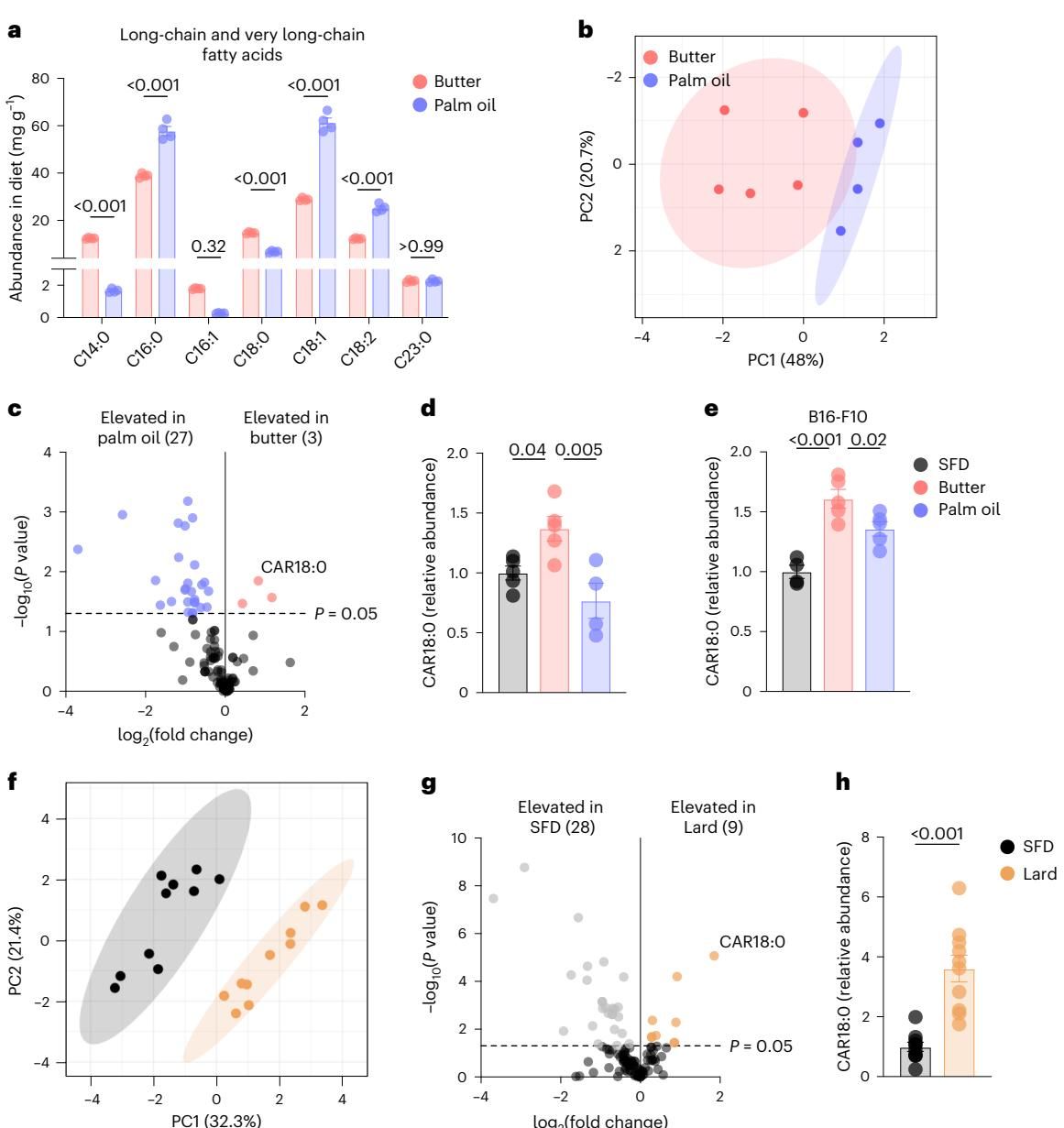
这种在血液中游荡的代谢物,成为了T细胞的“克星”。体外实验证实,CAR18:0并非直接“杀死”T细胞,而是通过抑制其功能来实施破坏。当CD8+ T细胞暴露于高浓度的CAR18:0环境中时,它们虽然存活了下来,却丧失了分泌抗癌细胞因子IFNγ的能力(图[6]a-d),且这种抑制作用随浓度升高而增强。
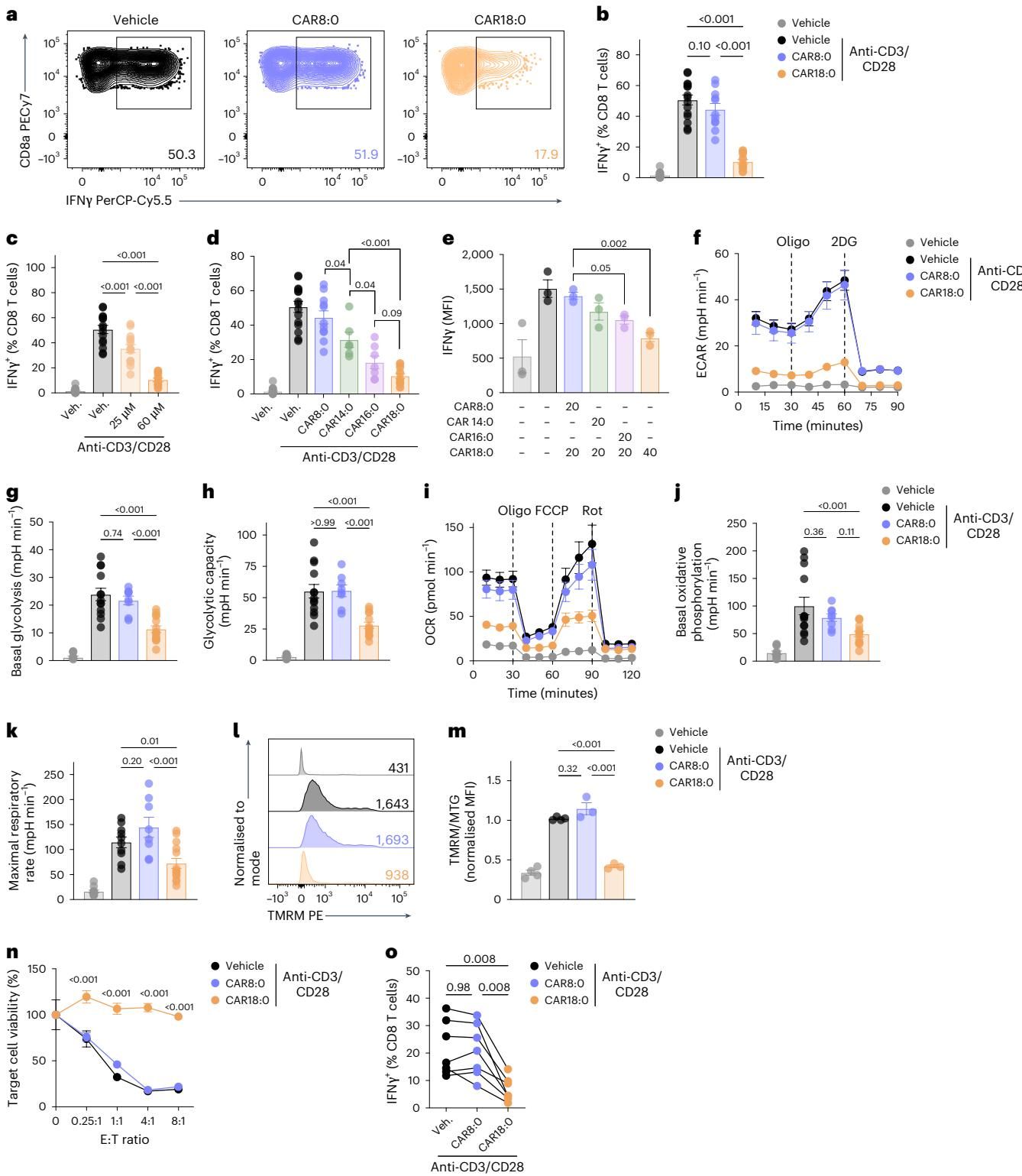
深入的机制研究表明,CAR18:0直接攻击了T细胞的“能量工厂”——线粒体。如图[6]f-m所示,经CAR18:0处理的T细胞,其线粒体膜电位显著下降(去极化),原本旺盛的糖酵解和氧化磷酸化代谢速率双双跌落谷底。失去了能量支撑的CD8+ T细胞,就像被切断了电源的机器,在面对肿瘤细胞时只能“望洋兴叹”,杀伤效率大幅降低(图[6]n)。
这一发现完美解释了为何棕榈油饮食具有保护作用:因为它天然含有的C18:0较少,摄入后不会导致体内积累这种能够特异性毒害T细胞线粒体的代谢“毒药”。
4. 结语:从“少吃点”到“吃对点”,癌症治疗的下一块拼图
这项发表于《Nature Metabolism》的研究,为我们理解饮食、肥胖与癌症之间的复杂关系提供了一块至关重要的拼图。它有力地证明,在这个微观的代谢战场上,脂肪的“质”往往比“量”更具决定性。
这一发现为“精准营养”辅助癌症治疗打开了极具想象力的大门。未来的抗癌策略或许不再仅仅局限于放化疗和免疫药物,一份精心设计的“免疫友好型食谱”可能成为患者康复路上的重要盟友。例如,对于肥胖的癌症患者,即便短期内难以通过减肥逆转代谢异常,通过替换膳食脂肪的来源——减少富含硬脂酸的动物脂肪摄入,转而选择植物来源的油脂——或许就能在不经意间为体内的免疫细胞“松绑”,助其重获杀敌之力。
当然,从小鼠模型走向人类临床仍有漫长的距离。人类的饮食结构远比实验中的单一饲料复杂,且不同肿瘤类型对脂肪的敏感度也不尽相同。但无论如何,这项研究都向我们抛出了一个值得深思的问题:在追求健康的长跑中,我们是否一直过于关注体重秤上的数字,而忽视了餐盘中那些看不见的“代谢密码”?
或许在不久的将来,医生开出的处方里,不仅有药片,还会有一瓶特定的食用油。
论文信息
- 标题:The source of dietary fat influences anti-tumour immunity in obese mice.
- 论文链接:https://doi.org/10.1038/s42255-025-01330-w
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-8
- 期刊/会议:Nature metabolism
- 作者:Britta Kunkemoeller, Hannah Prendeville, Claire McIntyre, ..., Lydia Lynch
本文由超能文献“资讯AI智能体”基于4000万篇Pubmed文献自主选题与撰写,并经AI核查及编辑团队二次人工审校。内容仅供学术交流参考,不代表任何医学建议。
分享



