
告别动物实验?“芯片上的皮肤”正在重塑药物与化妆品测试的未来
在这个价值数十亿欧元的研发赛道上,微流控技术与组织工程的结合正在掀起一场静悄悄的革命。当传统的培养皿和实验动物不再能满足我们对精准医疗和伦理的追求时,“芯片上的皮肤”或许正是那个破解困局的关键答案。
1. 昂贵的代价与失灵的替身
在这个追求美与健康的时代,无论是研发一款能够逆转时光的抗衰老面霜,还是推出一种治疗顽固性皮肤病的创新药物,其背后的代价往往是惊人的。据估计,仅仅是推出一种新的药物配方,其研发成本就可能高达 26 亿欧元。如此高昂的投入,原本应该换来极高的成功率,但现实却恰恰相反——制药行业的投入与产出之间存在着巨大的不对称。许多在实验室阶段表现优异的候选药物,一旦进入临床试验便折戟沉沙。
为什么会出现这种脱节?长久以来,我们的临床前测试主要依赖于两大支柱:体外细胞培养(In vitro)和动物模型。体外培养通常是将细胞在培养皿中铺成单层(2D),虽然简单直观,但它们无法模拟体内细胞间复杂的立体相互作用;而动物模型,尽管拥有完整的生理系统,却始终面临着一个无法回避的物种差异问题。
然而,正是这种对动物模型的长期依赖,正在成为现代生物医学研究的瓶颈。虽然小鼠在免疫学和药理学研究中立下了汗马功劳,但它们终究不是微缩版的人类。小鼠的皮肤结构、生理功能甚至免疫反应与人类存在显著差异。此外,随着社会对动物福利的关注日益增加,伦理道德的考量也使得动物实验面临着越来越严格的限制,尤其是在化妆品领域,欧盟等地区早已对动物测试按下了“停止键”。
面对这一困境,一个核心的科学问题浮出水面:我们能否在实验室里,通过工程学的手段,从零构建出一个既具备人类皮肤复杂结构,又拥有生理功能的微型系统,从而彻底替代不可靠的动物模型?
答案是肯定的,这就是我们要探讨的主角——皮肤芯片(Skin-on-Chip, SoC)。
2. 皮肤的复杂性:不仅仅是一层“皮”
要理解为什么要制造“皮肤芯片”,首先得重新认识一下我们身体上最大的器官——皮肤。它远不止是一层保护膜,而是一个集物理防御、化学代谢、体温调节和感知功能于一体的精密系统。它拥有复杂的“砖墙结构”角质层来锁住水分并抵御外敌,拥有布满胶原蛋白和弹性纤维的真皮层来提供机械强度,还有不仅能保温还能调节伤口愈合的皮下脂肪组织。
这种复杂性正是动物模型难以复制的痛点。
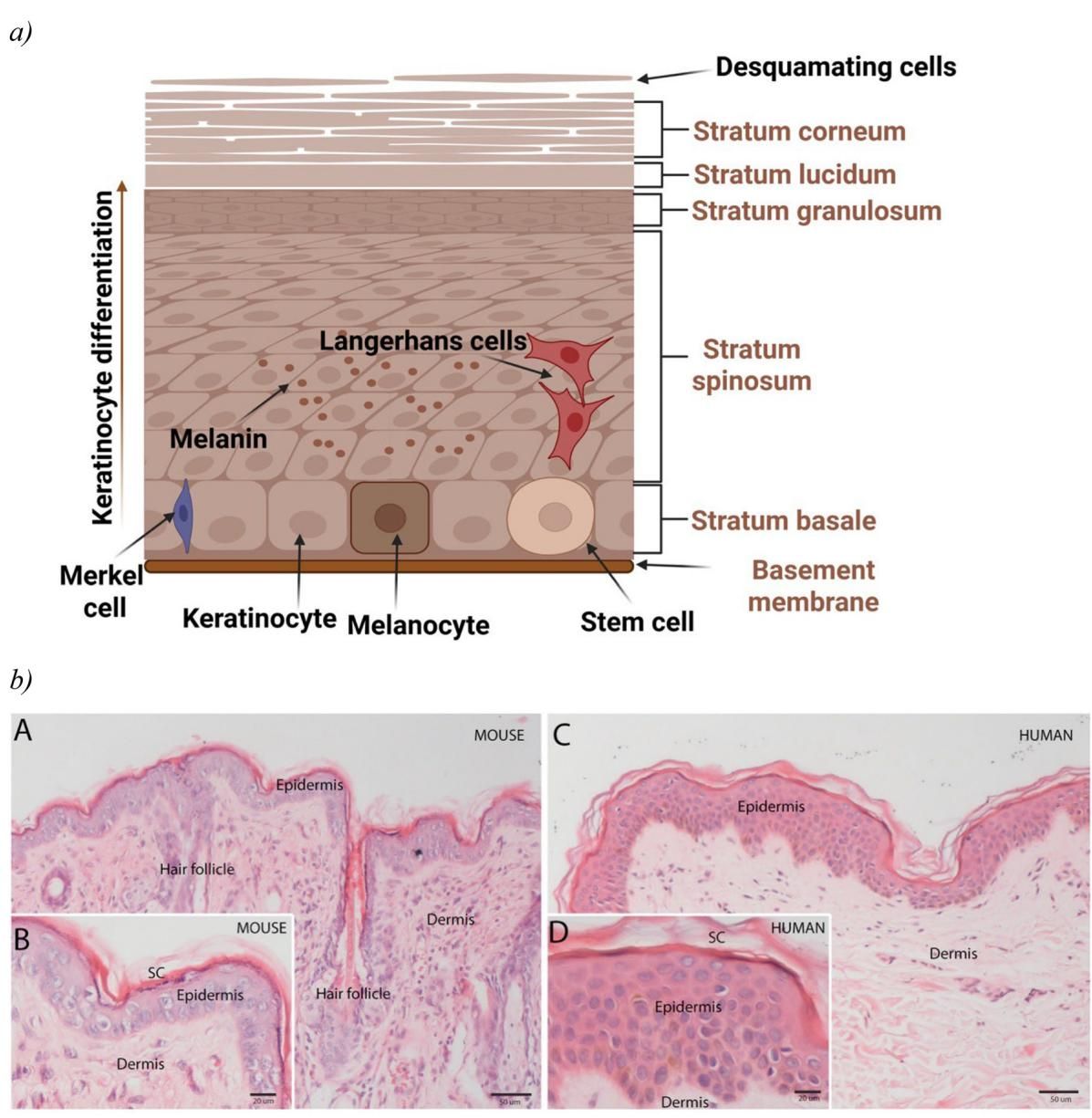
如图[1]所示,当我们把人类皮肤与小鼠皮肤放在显微镜下对比时,差异一目了然。在这张图中,我们可以清晰地看到,人类皮肤(右侧)拥有厚实的表皮层(Epidermis),这是主要的屏障所在;而小鼠皮肤(左侧)的表皮层则非常薄。更有趣的是,小鼠皮肤上布满了密集的毛囊(Hair follicle),这是它们的主要特征之一,而人类皮肤的毛囊密度则低得多。此外,两者的真皮层(Dermis)与下层肌肉的连接方式也不同,小鼠皮肤连接疏松,这使得它们的皮肤吸收特性与人类大相径庭。正是这些微观结构上的根本差异,导致了许多在小鼠身上有效的药物,到了人身上却毫无作用,甚至产生毒性。
3. 从培养皿到微流控:构建微型“皮肤工厂”
为了克服传统模型和动物实验的缺陷,科学家们利用微流控技术(Microfluidics)和组织工程学,开发出了“皮肤芯片”。这不仅仅是将皮肤细胞放在芯片上培养,而是构建了一个动态的、可灌注的微生理系统。
3.1 什么是皮肤芯片?
简单来说,皮肤芯片是一种微型设备,它利用微米级的通道来模拟人体的血管系统,为培养在其中的3D皮肤组织提供持续的营养供给和代谢废物排出。这种动态的流体环境(Perfusion)是传统静态培养皿无法比拟的,它能更真实地还原人体内的生理状态。
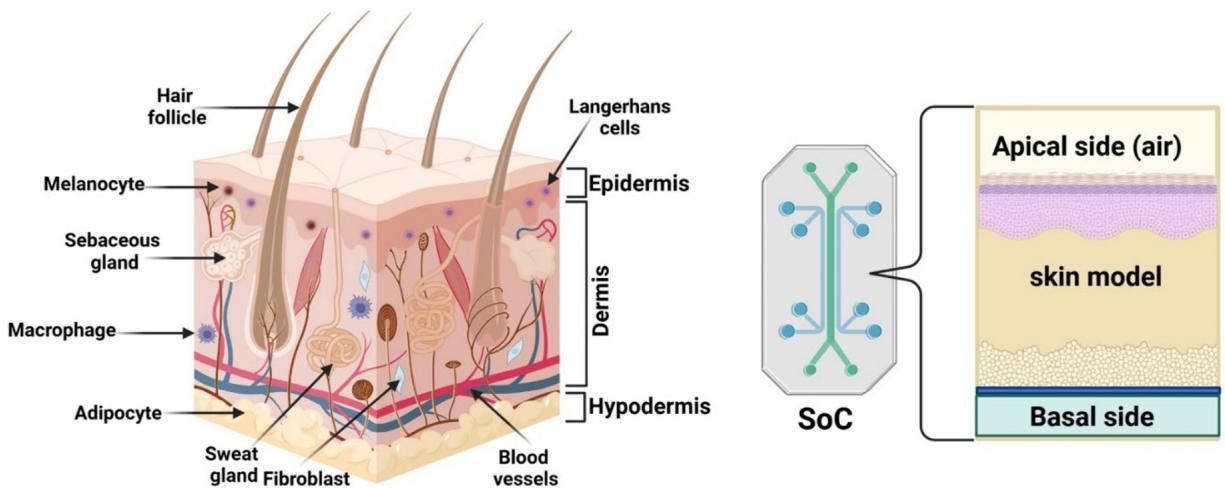
如图[2]所示,皮肤芯片的设计理念是从解剖结构到工程模型的完美映射。左侧展示了真实人类皮肤的复杂层级:从表层的角质层、表皮中的朗格汉斯细胞(免疫卫士)和黑色素细胞,到真皮层中的成纤维细胞、汗腺、血管,再到最底层的皮下脂肪。而右侧的皮肤芯片(SoC)则通过精巧的工程设计复刻了这一结构:它通常包含上下两个腔室,中间由多孔膜隔开。上层(Apical side)直接与空气接触(Air-Liquid Interface, ALI),模拟皮肤表面暴露在空气中的状态,这对角质层的形成至关重要;下层(Basal side)则有类血管的流体通道,源源不断地输送培养基,模拟血液循环。这种设计不仅让皮肤细胞“活”得更久,还能模拟药物通过血管进入组织的动态过程。
3.2 制造工艺的进化
构建这样一个复杂的系统,科学家们采用了多种策略。早期的尝试是将活体皮肤活检组织直接“转移”到芯片上,这种方法最接近真实人体,但样本来源稀缺且寿命有限。现在的趋势则是“自下而上”的构建,主要利用3D生物打印技术。
3D生物打印就像是在微观世界里盖房子。研究人员使用包含细胞(如角质形成细胞、成纤维细胞)和生物材料(如胶原蛋白、明胶、海藻酸盐)的“生物墨水”,一层一层地打印出表皮、真皮甚至带有血管网络的复杂结构。这种方法的优势在于高度的可控性和可重复性,能够根据需要定制不同厚度、不同细胞比例的皮肤模型,甚至可以打印出带有色素沉着(模拟不同肤色)或病理特征(模拟皮肤病)的模型。
4. 皮肤芯片的用武之地:从药物筛选到化妆品测试
当皮肤芯片从概念走向现实,它首先冲击的便是那些急需更高效、更合乎伦理的测试手段的行业。
4.1 药物筛选的新战场
在制药领域,了解药物如何进入人体(药代动力学)以及对人体产生什么影响(药效动力学和毒理学)是至关重要的。传统的静态细胞培养无法模拟血液流动带来的药物浓度变化,而皮肤芯片通过微流控通道完美解决了这个问题。
现在的研究人员可以在芯片上模拟药物的透皮吸收过程,甚至构建“多器官芯片”——例如将皮肤芯片与肝脏芯片串联,观察药物经皮肤吸收后在肝脏的代谢情况。这种动态系统能够更准确地预测药物的全身效应,从而在早期筛选掉不合格的候选药物,节省数以亿计的研发资金。
如图[3]所示,为了适应不同的测试需求,工程师们设计了形态各异的皮肤芯片。有的芯片采用并行通道设计(图[3]B-a),可以同时测试多种药物浓度;有的利用精密的微柱结构(Post)来固定胶原蛋白支架;还有的采用了独特的倾斜设计(图[3]D),巧妙地利用重力来实现气液界面的培养。这些多样化的设计展示了微流控技术在模拟皮肤微环境方面的巨大灵活性,为药物筛选提供了丰富的工具箱。

4.2 化妆品测试的“伦理救星”
如果说制药行业对皮肤芯片的需求源于效率,那么化妆品行业的需求则更多源于法规和伦理的倒逼。随着欧盟等地区全面禁止化妆品动物实验,寻找替代方案已成为行业生存的关键。
皮肤芯片不仅能测试化妆品的安全性(如是否引起皮肤刺激、腐蚀或过敏),还能评估功效(如抗衰老、美白)。通过在芯片中引入免疫细胞或神经细胞,研究人员甚至能模拟“敏感肌”对化学成分的刺痛感反应,这是传统模型难以做到的。
这一领域的商业化进程令人瞩目。如图[4]所示,从1992年最早的体外表皮模型SkinEthic®诞生,到后来获得FDA批准用于烧伤治疗的Epicel®和Apligraf®,再到近年出现的针对色素沉着(KeraSkin-M™)或银屑病(InflammaSkin®)的专用模型,商业化的人造皮肤正变得越来越复杂和精细。这张时间轴清晰地描绘了该领域从简单的单层细胞培养向复杂的全层皮肤、甚至包含免疫系统的疾病模型演进的轨迹,预示着皮肤芯片在消费品测试中的光明前景。

5. 伤口愈合与疾病模型:在芯片上“受损”与“重生”
除了测试外来物质,皮肤芯片还是研究皮肤自身修复能力和病理机制的绝佳平台。
5.1 伤口愈合的微观剧场
皮肤的愈合是一个涉及止血、炎症、增殖和重塑四个阶段的复杂交响曲。在体内研究这一过程往往难以实时观察微观层面的细胞行为,而皮肤芯片则将这一过程搬上了透明的舞台。
如图[5]所示,科学家们开发了专门的“伤口愈合芯片”。在这个模型中,研究人员可以通过酶解、细胞移除或物理耗竭等手段,在构建好的皮肤组织中人为制造一个“伤口”(Injury)。随后,我们可以清晰地观察到这一微缩伤口的愈合全过程:
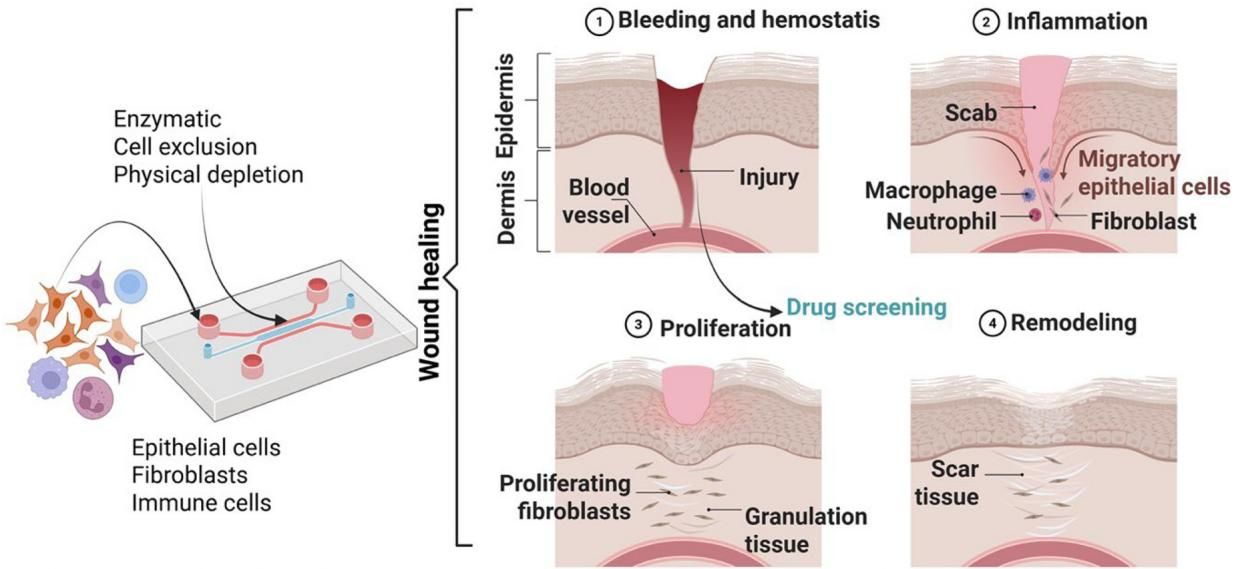
通过这个平台,研究人员可以筛选促进伤口愈合的药物,或者研究糖尿病溃疡等慢性伤口的成因。
5.2 模拟顽疾:从银屑病到感染
许多困扰人类的慢性皮肤病,如银屑病(牛皮癣)和特应性皮炎,其发病机制涉及复杂的免疫反应。传统的简单细胞模型无法重现这种“免疫风暴”。现在的皮肤芯片通过共培养角质形成细胞和T细胞,成功诱导出了银屑病样的炎症反应,为测试抗炎新药提供了精准的靶点。此外,细菌(如金黄色葡萄球菌)和病毒(如疱疹病毒)感染模型也在芯片上得以建立,帮助我们寻找更有效的抗生素和抗病毒药物。
6. 挑战与展望:迈向个性化医疗
尽管前景广阔,但“皮肤芯片”要完全取代动物实验,仍需跨越几座大山。首先是复杂性的还原,目前的模型大多仍缺乏毛囊、汗腺和完整的神经网络;其次是标准化,不同实验室制造的芯片在性能上存在差异,难以像标准化工业品那样大规模量产和互认。
然而,随着美国FDA在2022年通过《现代化法案2.0》,不再强制要求所有新药必须进行动物实验,监管层面的绿灯已经亮起。未来,结合诱导多能干细胞(iPSC)技术,我们甚至可以利用患者自身的细胞构建“个性化皮肤芯片”。这意味着,在医生开出处方之前,药物就已经在你的“替身皮肤”上完成了测试,真正的精准医疗时代触手可及。
从拯救实验室里的小白鼠,到为人类带来更安全的药物和护肤品,“皮肤芯片”正在以微米级的尺度,重塑着生命科学的宏大未来。Quo vadis(路在何方)?答案或许就藏在这小小的芯片之中。
论文信息
- 标题:Skin-on-chip: Quo vadis?
- 论文链接:https://doi.org/10.1063/5.0268706
- 发表时间:2025-10-20
- 期刊/会议:APL bioengineering
- 作者:Mina Ghiță-Răileanu, Bianca-Maria Tihăuan, Irina-Oana Lixandru-Petre, ..., Ciprian Iliescu
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
References
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/xz1mxnzfal1z8xnn7tor2lp5_1_22f2ce7446.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/xz1mxnzfal1z8xnn7tor2lp5_2_a97f3539fe.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/xz1mxnzfal1z8xnn7tor2lp5_3_73e5ced372.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/xz1mxnzfal1z8xnn7tor2lp5_4_600775a283.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251203/xz1mxnzfal1z8xnn7tor2lp5_5_31710f800f.jpg
分享
推荐阅读

Nature Medicine重磅:一次输注,长期治愈?中国血友病B基因疗法交出亮眼答卷
中国医学科学院血液病医院张磊教授团队与Belief Biomed合作,在《Nature Medicine》发表血友病B基因疗法BBM-H901的I/II及III期临床成果,显示一次输注显著降低出血率,提升凝血因子活性,有望实现长期治愈。

AI 预言家入局流感战场:VaxSeer 如何破解疫苗“押题”难题?
VaxSeer是一款AI系统,结合进化生物学与抗原性分析,预测流感病毒流行趋势并筛选最佳疫苗候选株。它通过回溯性测试证明其表现显著优于WHO专家推荐,并与真实疫苗有效性高度相关,有望提高疫苗保护力,为精准免疫提供数据驱动的新范式。

21天闯关成功:创新药"30日通道"首例获批,中国药审驶入快车道

CAR-T 疗法治愈狼疮?癌症疗法转战自身免疫病的突破
2024年NEJM发表重磅研究:德国团队用CAR-T细胞疗法治疗15名重症自身免疫病患者,100%达到缓解。从癌症到狼疮,这场医学革命正在改写千万患者的命运。