
跨界抗衰?“减肥神药”利拉鲁肽在阿尔茨海默病临床试验中展现惊人脑保护潜力
1. 走出“淀粉样蛋白”的迷雾
长久以来,阿尔茨海默病(AD)的治疗研发仿佛被困在了一个名为“β-淀粉样蛋白”的迷宫中。尽管近年来像Lecanemab这样的抗淀粉样蛋白抗体药物为患者带来了一线曙光,但它们仅能适度延缓病情,且往往伴随着脑水肿或出血的风险。科学界逐渐达成共识:AD是一种复杂的、多重病理机制驱动的疾病,单纯清除大脑中的“斑块”或许并不足以扭转乾坤。
然而,就在神经科学家们苦苦寻找新靶点时,内分泌领域的“明星”药物——GLP-1受体激动剂(即大众熟知的“减肥神药”同类药物),意外地闯入了脑科学的视野。这类药物不仅能调节血糖和体重,在动物实验中还展现出了令人惊叹的神经保护能力:从减少神经炎症到促进神经元再生,它们仿佛是修复大脑的多面手。但是,这种在小鼠身上展现的“魔法”,能否在人类复杂的病态大脑中重现?
为了回答这一核心科学问题,来自伦敦帝国理工学院的Paul Edison教授团队开展了一项代号为“ELAD”的多中心、随机、双盲、安慰剂对照的2b期临床试验。这项研究不仅不仅挑战了传统的单一治疗思路,更为AD的治疗版图拼上了一块关键拼图。
2. 喜忧参半的“成绩单”:代谢未改,但认知获益
这项发表于《Nature Medicine》的重磅研究纳入了204名轻度至中度阿尔茨海默病患者。研究人员并没有选择糖尿病患者,而是专注于那些单纯患有AD的人群,试图剥离血糖改善带来的干扰,直击药物对大脑的直接影响。受试者被随机分配接受每日一次的利拉鲁肽(Liraglutide)皮下注射或安慰剂治疗,持续整整52周。
研究的首要终点是大脑葡萄糖代谢率的变化。通常情况下,随着AD病情恶化,大脑利用葡萄糖的能力会显著下降,这是神经元功能衰退的标志。令人遗憾的是,从主要终点来看,利拉鲁肽并没有显著改变大脑皮层特定区域的葡萄糖代谢率(p=0.14)。研究团队推测,这可能与试验设计中扫描前3天的“停药期”有关,这种设计虽然排除了药物对血管的急性影响,但也可能让代谢效应有所回落。
然而,当研究人员将目光转向临床认知功能评估时,惊喜出现了。虽然这主要是一个探索性的2b期试验,但在次要终点中,利拉鲁肽展现出了强劲的潜力。
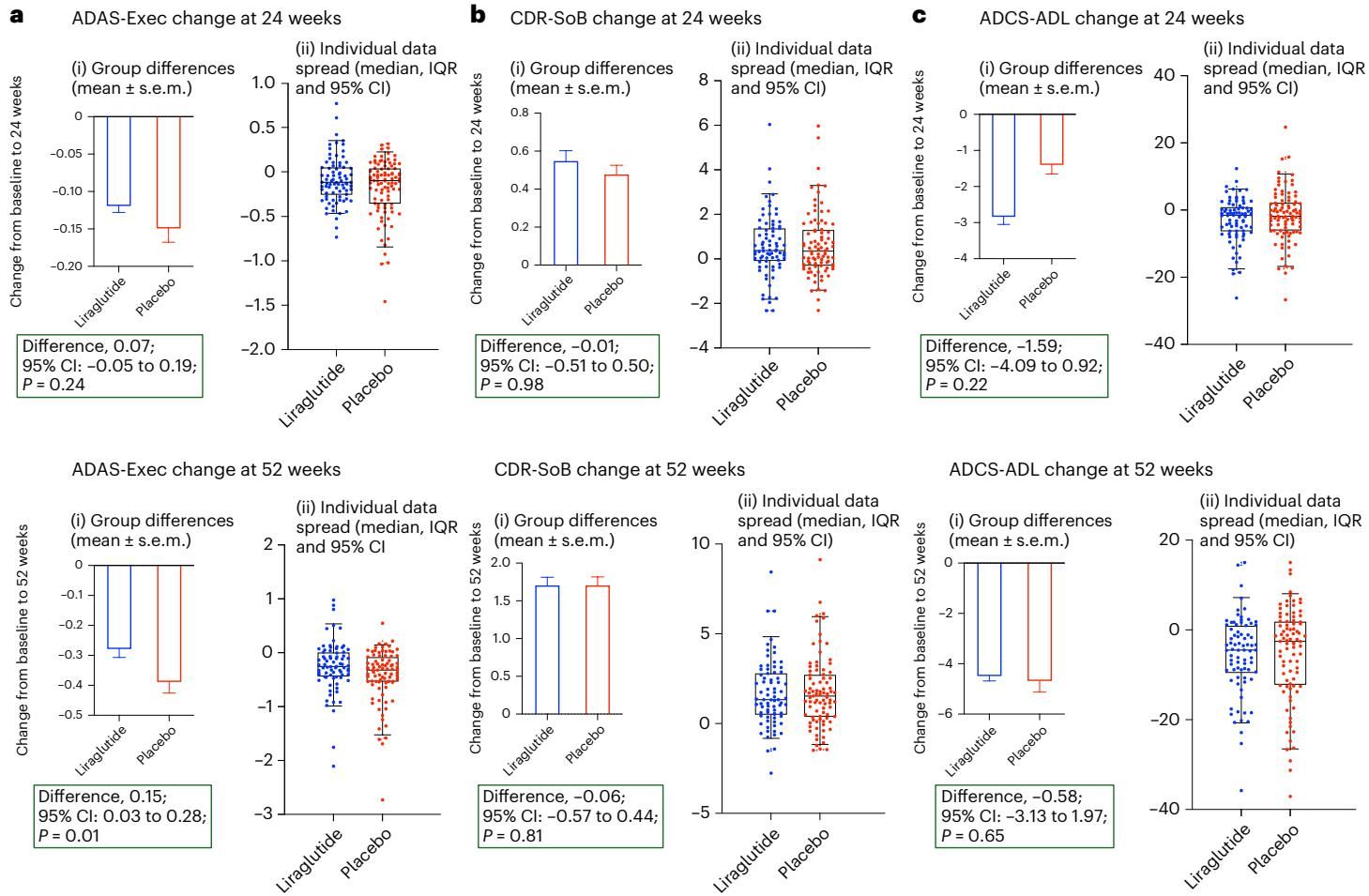
如图[1]所示,这项研究揭示了利拉鲁肽在保护认知功能方面的显著优势。我们可以清晰地看到,图表展示了ADAS-Exec(阿尔茨海默病评估量表-执行域)评分随时间的变化情况。图中的红线代表安慰剂组,其数值呈现明显的下降趋势,意味着认知功能的持续恶化;相比之下,代表利拉鲁肽治疗组的蓝线则显得更为平稳。这种差异在治疗进行到24周时开始显现,并持续扩大,直到52周时达到了统计学显著水平(p=0.01)。箱线图进一步直观地量化了这种差异,治疗组患者的认知衰退速度明显慢于安慰剂组。这一结果提示我们,GLP-1受体激动剂可能并非通过仅仅改善当下的症状来起效,而是通过某种长期的神经保护机制,延缓了疾病的进程。
3. 看得见的“脑保护”:由内而外的结构重塑
如果说认知评分的改善是患者的主观感受,那么磁共振成像(MRI)的数据则为这种改善提供了坚实的解剖学证据。AD患者的大脑通常会经历不可逆转的萎缩,尤其是负责记忆的海马体和颞叶区域。
在这项研究中,通过精密的体积测量,研究人员发现利拉鲁肽治疗组的脑萎缩速度显著慢于安慰剂组。特别是在颞叶、额叶以及全脑灰质体积的测量上,治疗组都表现出了明显的优势。这种结构上的保护作用在临床试验中并不常见,它强有力地支持了利拉鲁肽具有修饰疾病进程(disease-modifying)的潜力。
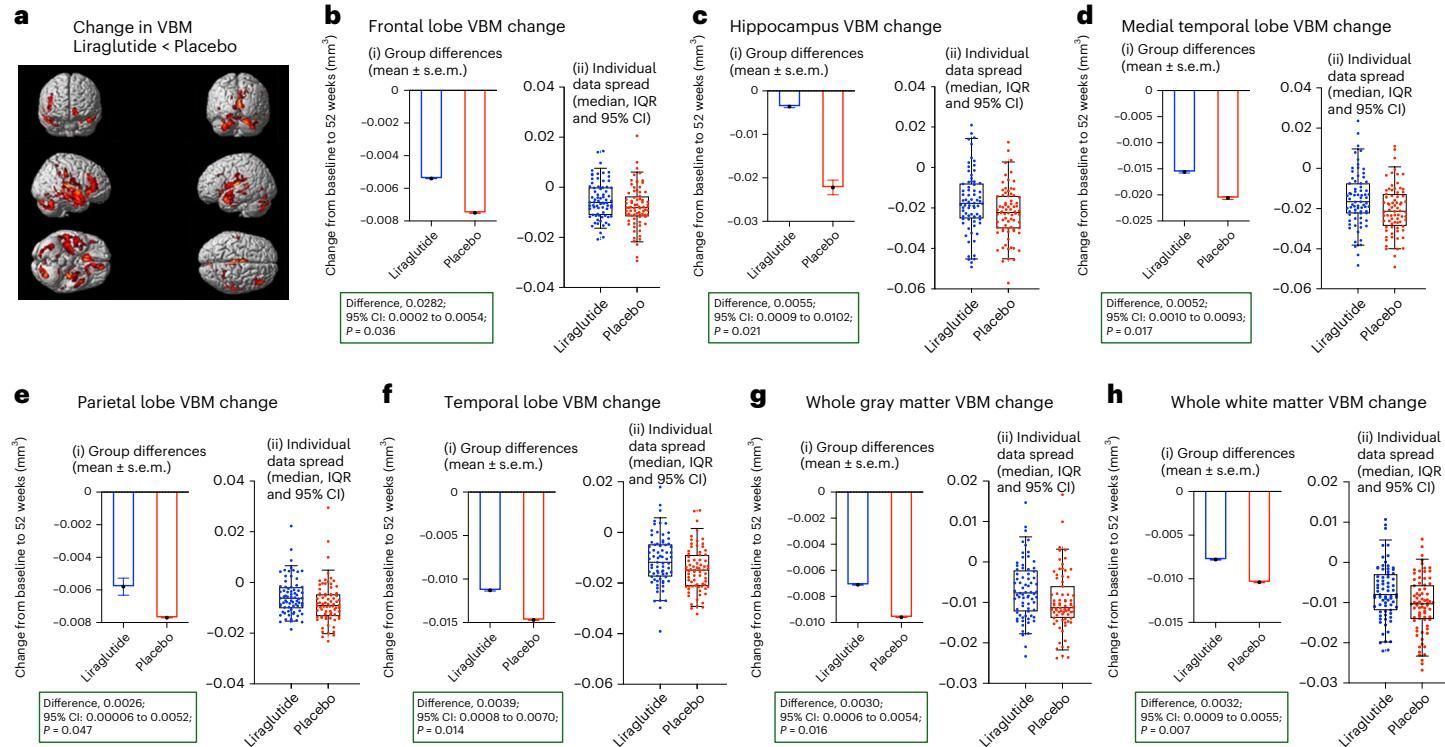
为了更直观地展示这种保护作用的空间分布,研究使用了基于体素的形态学分析(VBM)。如图[2]所示,这组大脑扫描图像生动地描绘了药物起效的“战场”。图中的红色和黄色区域代表了与安慰剂组相比,利拉鲁肽治疗组中灰质体积萎缩显著减缓的脑区。我们可以从图中解读出,这种保护作用并非局限于某一点,而是广泛分布于额叶(图b)、颞叶(图f)甚至整个皮层灰质(图g)。尤其是图a中那片醒目的红色区域,直观地告诉我们药物是如何在这些关键脑区筑起一道“防波堤”,对抗神经退行性病变带来的侵蚀。这种广泛的结构保护与前述的认知功能保留形成了完美的呼应。
4. 安全性与未来展望
对于一款老药新用的药物,安全性是其能否快速临床转化的关键。研究显示,利拉鲁肽在非糖尿病的AD患者群体中耐受性良好。虽然不出所料,治疗组出现了更多的胃肠道副作用(如恶心、体重减轻),这是GLP-1类药物的典型特征,但大多数并不严重且并未导致严重的健康风险。
这项ELAD研究虽然在主要代谢终点上未达预期,但其在认知保护和脑结构维持上的积极信号令人振奋。它揭示了AD治疗的一种新可能:通过靶向胰岛素信号通路、减轻神经炎症或改善线粒体功能,我们或许能在不直接攻击淀粉样蛋白的情况下,也能有效地保护大脑。未来的AD治疗方案,很可能是一杯“鸡尾酒”——将抗淀粉样蛋白药物与像利拉鲁肽这样的神经保护剂联用,多管齐下,为患者争取更多的时间与尊严。
论文信息
- 标题:Liraglutide in mild to moderate Alzheimer's disease: a phase 2b clinical trial.
- 论文链接:https://doi.org/10.1038/s41591-025-04106-7
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-12-1
- 期刊/会议:Nature medicine
- 作者:Paul Edison, Grazia Daniela Femminella, Craig Ritchie, ..., Clive Ballard
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
References
分享
推荐阅读

21天闯关成功:创新药"30日通道"首例获批,中国药审驶入快车道

CAR-T 疗法治愈狼疮?癌症疗法转战自身免疫病的突破
2024年NEJM发表重磅研究:德国团队用CAR-T细胞疗法治疗15名重症自身免疫病患者,100%达到缓解。从癌症到狼疮,这场医学革命正在改写千万患者的命运。

从新冠到流感:mRNA疫苗技术的下一个战场
在近两万人参与的严格对照试验中,mRNA流感疫苗展示了比传统疫苗更优的保护效果。但更高的副作用发生率和对B型流感的"偏科",揭示了这项技术走向大规模应用前仍需跨越的障碍。

Science的研究:AI设计蛋白质"ChatGPT时刻"?4周让T细胞变身抗癌"导弹"
从数年到数周,AI正在重新定义癌症免疫治疗的时间表。丹麦与美国科学家开发的AI平台,能快速设计出"分子钥匙",让患者自身的T细胞精准识别并摧毁肿瘤细胞。