
Nature Medicine重磅:AI不仅能“算命”,还能“救命”?丹麦团队实证个性化医疗让术后并发症锐减
对于结直肠癌患者而言,手术往往是通往治愈的必经之路。随着现代医疗技术的飞速发展,手术本身的技术门槛已不再是唯一的挑战,围手术期的护理质量同样决定着患者的生死存款。然而,即便手术台上的操作行云流水,术后并发症的阴霾依然笼罩着许多患者。这些不良预后不仅是降低生存率、恶化肿瘤学结果的“头号杀手”,更是推高医疗成本的罪魁祸首。
在临床实践中,外科医生面临着一个棘手的难题:如何在一大群患者中精准地识别出那些“高风险分子”,并为他们量身定制围手术期的干预措施?现有的医疗资源有限,若对所有人都进行高强度干预,既不现实也无必要;若仅凭经验或简单的评分工具,又往往难以捕捉个体之间复杂的差异。这种“一刀切”或“盲人摸象”式的风险评估,让精准医疗的落地变得步履维艰。
这引出了一个亟待解决的核心科学问题:我们能否利用真实世界的海量数据,构建一个不仅能“预测”风险,更能直接“指导”临床决策的AI模型,从而切实改善患者的术后命运?
近期,发表在顶刊《Nature Medicine》上的一项研究给出了令人振奋的答案。来自丹麦西兰大学医院(Zealand University Hospital)的研究团队,利用丹麦国家登记处的18,403名结直肠癌患者数据,开发并验证了一款基于人工智能的风险预测模型。更重要的是,他们并未止步于“纸上谈兵”,而是将该模型真正植入到了临床工作流中,作为决策支持工具实现了个性化的围手术期治疗。
1. 从数据海洋到临床决策:一场“四步走”的进阶
这项研究之所以引人注目,不仅在于其算法的精准,更在于其完整的落地路径。研究人员并没有直接把一个黑盒模型扔给医生,而是设计了一个严谨的“四步走”实施策略:从基于注册数据的临床问题构建,到模型的开发与验证,再到临床实际应用,最后评估其临床结局与经济效益。
如图[1]所示,这项研究的设计蓝图清晰地展示了从问题探索到解决方案落地的全过程。研究团队首先利用丹麦完善的国家级医疗数据库(DCCG)进行“基于问题的学习”,探索风险因素与死亡率的关系;随后,他们将这些数据标准化(OMOP CDM格式)以开发和内部验证模型;紧接着,在一个单中心回顾性队列(RCC)中进行外部验证并定义风险分组;最终,在2023年2月1日,他们正式在临床中实施了这一AI辅助的个性化治疗方案(PCC)。
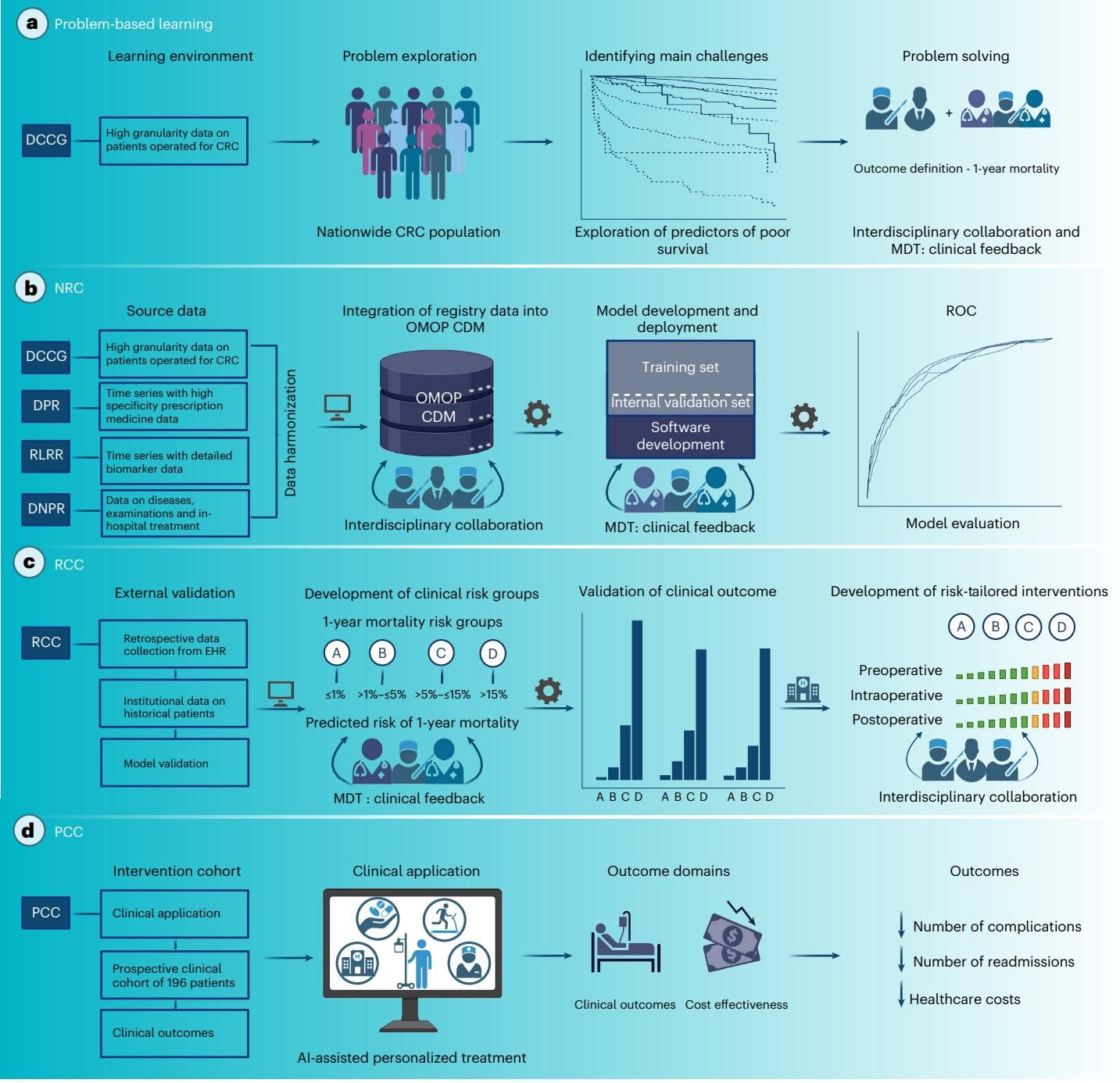
通过图[1]我们可以看到,研究不仅关注算法本身(图中的b部分),更强调了临床端的反馈循环(MDT: Clinical feedback)以及针对不同风险分层(A、B、C、D四组)所匹配的阶梯式干预措施(图中的c部分)。这种闭环设计,确保了AI技术不仅仅是停留在计算机里的代码,而是转化为了手术室外实实在在的治疗方案。
1.1 为什么我们需要多维度的“AI算命”?
在模型开发之前,研究团队首先通过“基于问题的学习”揭示了传统单一指标的局限性。他们分析了查尔森合并症指数(CC-index)、WHO体能状态评分(WHO PS)、UICC癌症分期以及年龄等因素与1年生存率的关系。
结果并不出人意料:合并症越多、体能越差、分期越晚、年龄越大,生存期通常越短。但是,一个关键的发现是,这些传统的预后因素之间相关性并不强。也就是说,一个年轻患者可能因为严重的合并症而面临高风险,而一个高龄患者可能因为体能极佳而风险较低。这意味着,单一维度的评估就像是盲人摸象,无法拼凑出患者风险的全貌。这也正是为什么需要AI来整合这些复杂的、非线性的多维数据,以提供一个“全景式”的术前风险评估。
1.2 打造“火眼金睛”:精准锁定高危人群
为了构建这个能够预知未来的“水晶球”,研究团队最终筛选了58个关键变量进入模型,这些变量涵盖了人口统计学、合并症、用药史以及详细的生化指标。模型的核心任务是预测患者在术后1年内的死亡风险。
在验证阶段,该模型展现出了令人信服的预测能力。如图[2]所示,我们能够直观地评估模型的性能表现。左侧的ROC曲线(Receiver Operating Characteristic curve)展示了模型在不同数据集上的区分度,其中外部验证集的曲线下面积(AUROC)达到了0.79,这意味着模型在面对全新的、未曾见过的患者数据时,依然保持了很高的判断准确性。而右侧的校准曲线则显示,预测概率与实际观察到的风险比例高度吻合,尤其是在低风险区间,模型的预测几乎与现实严丝合缝。

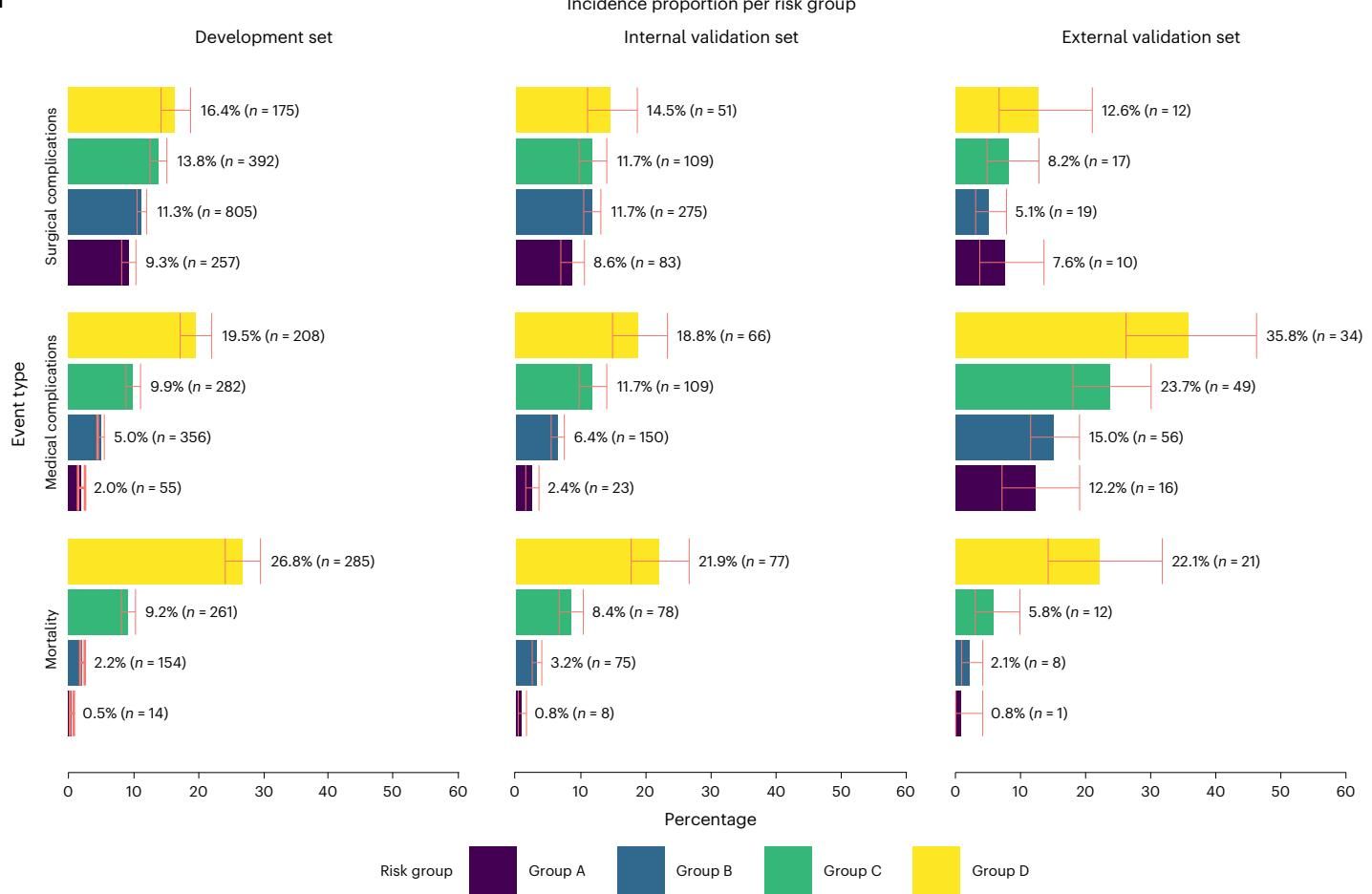
基于模型计算出的死亡概率,研究人员将患者划分为四个临床风险组:A组(低风险,≤1%)、B组(中低风险,>1% - ≤5%)、C组(中高风险,>5% - ≤15%)和D组(高风险,>15%)。这种分层不仅仅是数字游戏,它直接对应着现实中并发症的发生概率。
从图[3]中我们可以清晰地看到风险分层的临床意义。该图展示了在不同数据集和不同风险组别中,各类术后不良事件的发生比例。随着风险等级从A组上升到D组(黄色柱状图代表D组),无论是手术并发症、医疗并发症还是死亡率,其发生比例都呈现出显著的阶梯式上升趋势。这有力地证明了,该AI模型就像一个经验丰富的老专家,能够精准地将那些潜藏着巨大风险的患者从人群中“揪”出来,为后续的精准干预提供了坚实的靶点。
2. 逆转命运:AI导航下的临床奇迹
模型建好了,但这只是万里长征的第一步。真正的挑战在于:当医生根据AI的建议调整治疗方案后,患者的结局真的变好了吗?
2023年2月1日,西兰大学医院正式引入了这套AI决策支持系统。对于被AI判定为高风险的患者(如C组和D组),医疗团队并未坐以待毙,而是启动了更为积极的干预措施——从术前的纠正贫血、营养支持、高强度间歇训练,到术中的目标导向液体治疗,再到术后入住监护室(PACU)及早期多学科查房。这种“量体裁衣”式的治疗策略,带来了惊人的改变。
2.1 并发症发生率的“断崖式”下跌
通过对比引入AI前的“标准治疗组”(RCC,806人)和引入AI后的“个性化治疗组”(PCC,194人),研究结果令人振奋。最核心的指标——综合并发症指数(CCI)>20的严重并发症发生率,从标准治疗组的28.0%显著下降到了个性化治疗组的19.1%。这意味着,每10个原本可能遭遇严重术后打击的患者中,就有1个因为AI的介入而幸免于难。
如图[4]所示,这一临床获益在统计学上得到了强有力的支撑。图a展示了严重并发症(CCI > 20)的发生情况,右侧的森林图清晰地指出,个性化治疗(PPT)相较于标准治疗,其调整后的比值比(OR)为0.63,意味着发生严重并发症的风险降低了近40%。同样,图b展示了医疗并发症(如肺炎、心血管事件等)的发生率从37.3%骤降至23.7%,OR值仅为0.53,风险几乎减半。这些数据就像一个个强有力的注脚,证明了AI指导下的精准干预能切实地为患者挡下术后的“枪林弹雨”。

2.2 既省钱又救命的“双赢”账单
除了临床指标的改善,这项研究还算了一笔经济账。在传统的观念里,个性化医疗往往意味着昂贵的投入。但是,该研究的成本效益分析显示,通过减少昂贵的并发症治疗和再入院,每位接受个性化治疗的患者在术后第一年平均节省了约2,847美元(约合人民币2万元)。
这不仅意味着医疗资源的更高效利用,更代表了患者生活质量的实质性提升(质量调整生命年QALYs增加了0.020)。这种“花小钱办大事”,甚至“省钱办大事”的模式,为AI医疗在资源受限的现实世界中推广提供了极具说服力的理由。
3. 局限与展望:通往未来的桥梁
尽管这项研究交出了一份漂亮的答卷,但科学的严谨性要求我们审视其背后的局限。首先,这是一项非随机的“前后对照”研究,而非金标准的随机对照试验(RCT)。这意味着,虽然我们在时间轴上看到了显著的改善,但很难完全排除其他随时间变化的因素(如整体医疗水平的自然进步)对结果的潜在影响。此外,样本量相对较小且局限于单中心,也让这一模式能否在更广泛的医疗机构中“复制粘贴”还有待验证。
然而,这并不妨碍其作为里程碑式的意义。它打破了长期以来AI医疗“模型发完即止”的怪圈,真正走通了从“数据挖掘”到“临床获益”的全链路。它告诉我们,AI不应只是发表在期刊上的炫酷算法,更应成为医生手中的听诊器和手术刀,实实在在地改变每一个患者的命运。
目前,一项更大规模的多中心随机对照试验(NCT06645015)已在丹麦筹备启动。未来,随着更多高质量证据的涌现,我们有理由相信,这种由AI驱动的、基于个体风险画像的精准围手术期管理,将成为外科领域的新常态。对于那些即将在手术单上签字的患者来说,这或许是科技赋予他们最温暖的守护。
论文信息
- 标题:Clinical implementation of an AI-based prediction model for decision support for patients undergoing colorectal cancer surgery.
- 论文链接:https://doi.org/10.1038/s41591-025-03942-x
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-11
- 期刊/会议:Nature medicine
- 作者:Andreas Weinberger Rosen, Ilze Ose, Mikail Gögenur, ..., Ismail Gögenur
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
References
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/rngjgvdgg9glwg5m4930ck5i_1_4d09b9da82.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/rngjgvdgg9glwg5m4930ck5i_2_2f513ea37a.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/rngjgvdgg9glwg5m4930ck5i_3_a27840b7cd.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/rngjgvdgg9glwg5m4930ck5i_4_729da75d04.jpg
分享
推荐阅读

10亿肥胖患者的"救命药",WHO开了绿灯却标上天价
2025年12月1日,世卫组织发布首个GLP-1药物治疗肥胖指南,覆盖司美格鲁肽等三大药物。但年费用上万美元,2030年仅10%患者可及,药企与医保的博弈才刚开始。

MIT开源BoltzGen:AI设计蛋白质药物,向"不可成药"靶点宣战
MIT团队推出开源AI模型BoltzGen,在26个挑战性靶点上实现纳摩尔级结合亲和力,67%成功率打破蛋白质设计困境,免费商用或颠覆制药行业格局。

从新冠到流感:mRNA疫苗技术的下一个战场
在近两万人参与的严格对照试验中,mRNA流感疫苗展示了比传统疫苗更优的保护效果。但更高的副作用发生率和对B型流感的"偏科",揭示了这项技术走向大规模应用前仍需跨越的障碍。

世界首例!为一个婴儿"量身定制"的基因编辑疗法
费城儿童医院团队创造历史,在6个月内为罕见代谢病患儿开发定制化CRISPR基因编辑疗法,开启精准医疗"N=1"新时代