Nature重磅:打破免疫认知边界,小胶质细胞竟是神经元的“溶酶体酶外卖员”
在神经科学的传统殿堂里,小胶质细胞(Microglia)长期以来被贴着“大脑清洁工”或“免疫卫士”的标签。教科书告诉我们,它们游走在神经元之间,修剪多余的突触,吞噬细胞碎片,并在感染发生时充当第一道防线。我们习惯于认为,神经元是高高在上的“指令官”,而小胶质细胞则是默默奉献的后勤保障部队,主要负责应对损伤和病理状态。
然而,如果告诉你,在绝对健康的大脑中,神经元连基本的脂质代谢都需要仰赖小胶质细胞的“投喂”呢?
近日,发表在《Nature》上的一项重磅研究 “Microglia-neuron crosstalk through Hex-GM2-MGL2 maintains brain homeostasis” 彻底颠覆了我们对神经免疫互动的认知。来自德国弗莱堡大学神经病理学研究所的 Marco Prinz 团队揭示了一个惊人的机制:小胶质细胞竟然会向神经元“外卖”配送一种关键的溶酶体酶,以维持神经细胞膜的脂质平衡。一旦这条“酶以此”的供应链断裂,致命的神经退行性病变将不可避免。
这一发现不仅重新定义了大脑稳态的维持规则,更直接指出了治疗桑德霍夫病(Sandhoff disease)等溶酶体贮积症的全新路径。
1. 颠覆性的“酶以此”:一场跨细胞的代谢接力
故事的核心聚焦于一种名为 GM2 的神经节苷脂(Ganglioside)。作为神经元细胞膜的重要组成部分,GM2 就像一个个微小的信号浮标,参与着信号转导和膜转运。然而,这些脂质分子需要不断的更新迭代,旧的 GM2 必须被降解,否则它们就会像无法处理的垃圾一样在细胞内堆积,最终撑爆溶酶体。
负责降解 GM2 的关键,是一种名为 -氨基己糖苷酶(-hexosaminidase, Hex)的溶酶体酶,其 亚基由 Hexb 基因编码。长期以来,学界普遍认为神经元作为代谢极其旺盛的细胞,理应自给自足地生产这种酶。但是,研究人员在分析单细胞测序数据时发现了一个反常的现象:Hexb 基因在小胶质细胞中的表达量极高,而在神经元中却微乎其微。这不禁让人疑惑:难道神经元“放弃”了处理 GM2 垃圾的能力?
答案就在于一场精密的跨细胞协作。如图[1]所示,健康的脑稳态依赖于一场精密的“接力跑”:小胶质细胞不仅自身高表达 Hexb,还会通过经典的高尔基体分泌途径,将具有活性的 Hex 酶“打包”释放到细胞外空间。随后,神经元通过甘露糖-6-磷酸受体(M6PR)介导的内吞作用或巨胞饮作用,将这些“外卖”进来的酶摄取入胞,运输至自身的溶酶体中,从而完成对 GM2 的降解。
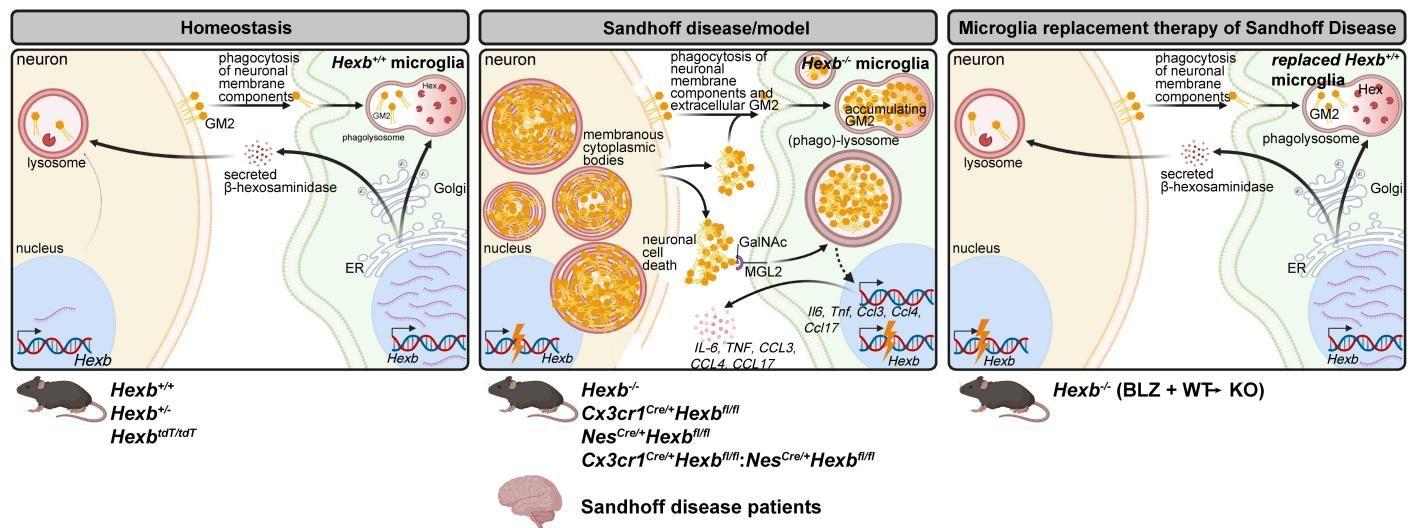
这是一个极其罕见的“旁分泌酶替代”(Paracrine Enzyme Replacement)生理现象。它意味着,小胶质细胞不仅仅是免疫细胞,更是神经元维持正常生理功能不可或缺的“代谢工厂”。
2. 致命的堆积:当“外卖”中断引发连锁反应
为了验证这一机制的重要性,研究人员构建了 Hexb 基因敲除小鼠模型。这种小鼠模拟了人类的桑德霍夫病——一种罕见且致命的神经退行性疾病。在缺乏功能性 Hex 酶的情况下,灾难发生了。
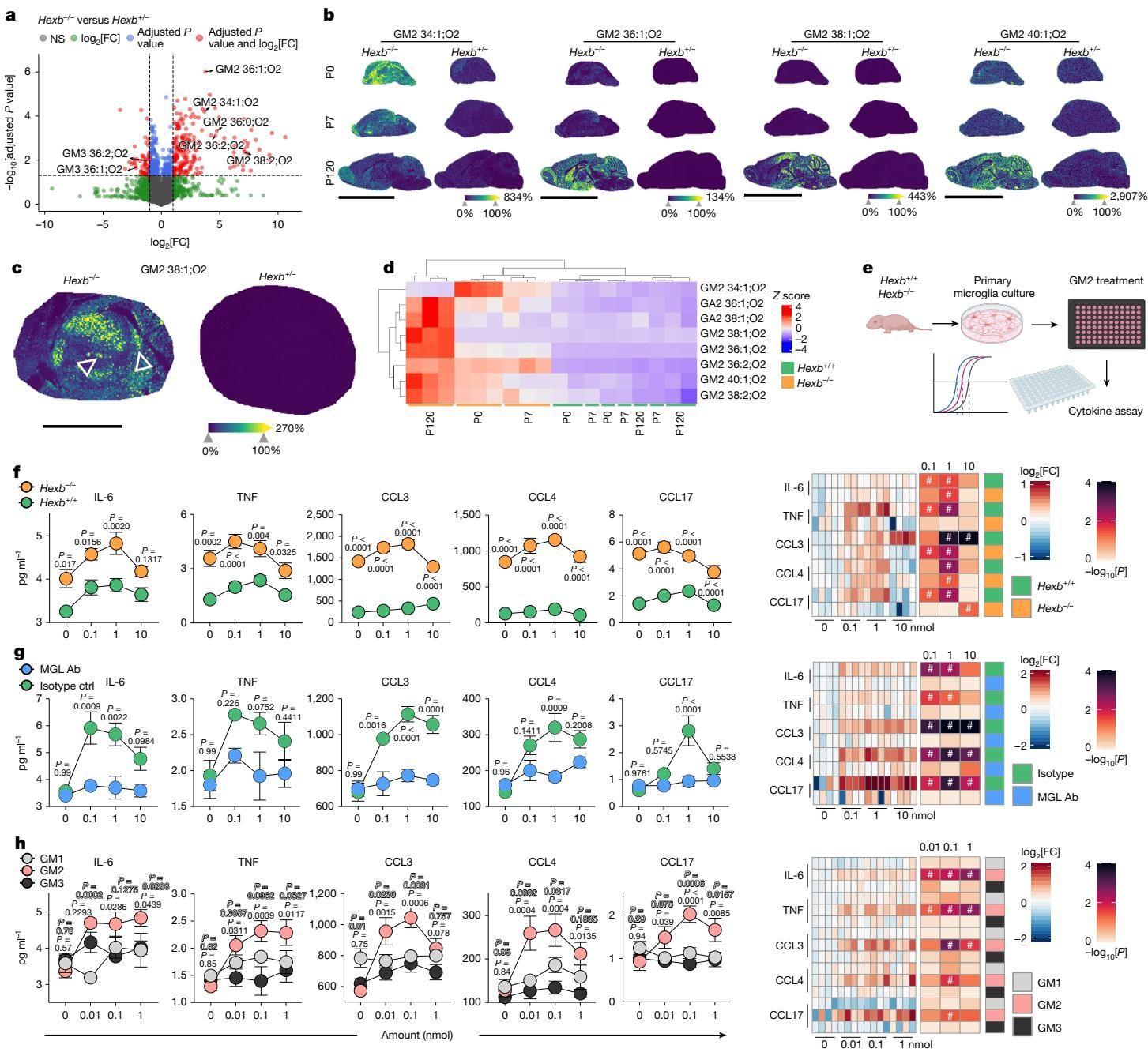
如图[2]的空间质谱成像(MALDI-MSI)数据所示,Hexb 缺失导致大脑中脂质图谱发生了剧烈改变。在出生后早期(P0),我们就能观察到 GM2 分子开始蓄积;随着年龄增长(至 P120),特定的 GM2 分子(如长链脂肪酸型 GM2)在丘脑等关键脑区呈现爆发式堆积。这种时空特异性的脂质堆积,与小鼠出现的运动失调、体重下降及早夭表型高度吻合。
更有趣的是,这种病理改变并非是单向的“神经元受损”。研究发现,堆积在神经元内的 GM2 会被释放出来,反过来刺激小胶质细胞。这形成了一个恶性循环:
- 酶缺失:小胶质细胞无法提供 Hex 酶。
- 底物堆积:神经元内 GM2 无法降解,进而释放到胞外。
- 免疫激活:胞外的 GM2 被小胶质细胞表面的巨噬细胞半乳糖型凝集素2(MGL2)受体识别。MGL2 能够特异性结合 GM2 末端的 N-乙酰半乳糖胺残基。
- 炎症风暴:MGL2 的激活促使小胶质细胞释放 IL-6、TNF 等促炎因子,进一步加剧神经退行性变。
从图[2]中我们还可以清晰地看到,正是这种脂质代谢的紊乱,直接驱动了小胶质细胞从“稳态”向“致病态”的转变,点燃了脑内的炎症之火。
3. 逆转命运:小胶质细胞替换疗法的奇迹
既然神经元的“病”根源在于小胶质细胞“断供”了关键酶,那么一个大胆的治疗思路应运而生:如果我们把这些“罢工”的小胶质细胞全部换掉,替换成能够正常生产 Hex 酶的健康细胞,能否挽救濒死的神经元?
为了验证这一设想,研究团队采用了一种巧妙的策略:首先使用 CSF1R 抑制剂(BLZ945)清除大脑内原有的缺陷小胶质细胞,腾出生态位;随后进行骨髓移植,让携带正常 Hexb 基因的供体细胞分化为小胶质细胞样细胞(Microglia-like cells, MLCs)并定植入脑。这相当于给大脑进行了一次“免疫系统大换血”。
实验结果令人振奋。如图[3]所示,这种“换血”疗法产生了奇迹般的疗效。在生存率统计中,接受了小胶质细胞替换的 Hexb 敲除小鼠(BLZ + Het KO,深绿色线),其生存曲线几乎与健康小鼠重合,完全摆脱了早夭的厄运;相比之下,未经治疗或仅接受骨髓移植但未清除原有小胶质细胞的小鼠(红色线和橙色线),依然在出生后 4 个月左右死亡。这一巨大的生存差异直观地表明,仅靠血液中游离的酶不足以治疗脑部病变,必须让健康的细胞真正“住进”大脑实质。

更深入的生化分析显示,这些外来的“新居民”不仅成功定植,而且工作效率极高。它们不仅恢复了脑内的 Hex 酶活性,更重要的是,它们成功清除了神经元内堆积如山的 GM2 垃圾(图[3]g, h)。随着代谢负担的解除,神经元的电生理功能恢复正常,小鼠的运动能力和体重也随之恢复。这意味着,通过重塑大脑的免疫微环境,我们确实可以跨越细胞边界,修复神经元的代谢缺陷。
4. 结语:不仅是卫士,更是保姆
这项研究不仅解开了桑德霍夫病(Sandhoff disease)的致病谜题,更在神经科学领域投下了一枚认知的震撼弹。它告诉我们,小胶质细胞与神经元的关系远比我们想象的要亲密和复杂——它们不仅是不仅是巡逻的“卫士”,更是通过溶酶体酶维持神经元生计的“保姆”。
这一发现为治疗各类溶酶体贮积症(Lysosomal Storage Disorders, LSDs)打开了一扇全新的大门。传统的酶替代疗法往往因无法穿透血脑屏障而对中枢神经系统病变束手无策,而基因治疗或细胞替换疗法,若能通过小胶质细胞这一“特洛伊木马”将治疗性酶精准投递给神经元,或许将成为未来的杀手锏。
然而,科学的探索永无止境。我们不禁要问:除了 Hex 酶,小胶质细胞的“外卖清单”上还有其他关键分子吗?在阿尔茨海默病、帕金森病等更广泛的神经退行性疾病中,这种“代谢互养”机制是否也发生了崩塌?当我们在未来审视大脑健康时,或许不应再孤立地关注神经元,因为每一个健康的神经元背后,都离不开一群默默“投喂”的小胶质细胞。
参考文献
- Frosch, M., et al. Microglia-neuron crosstalk through Hex-GM2-MGL2 maintains brain homeostasis. Nature (2025).
- Prinz, M., et al. Microglia and central nervous system-associated macrophages—from origin to disease modulation. Annu. Rev. Immunol. (2021).
- Sango, K. et al. Mice lacking both subunits of lysosomal -hexosaminidase display gangliosidosis and mucopolysaccharidosis. Nat. Genet. (1996).
- Masuda, T. et al. Novel Hexb-based tools for studying microglia in the CNS. Nat. Immunol. (2020).
- van Vliet, S. J. et al. Carbohydrate profiling reveals a distinctive role for the C-type lectin MGL in the recognition of helminth parasites and tumor antigens by dendritic cells. Int. Immunol. (2005).
论文信息
- 标题:Microglia-neuron crosstalk through Hex-GM2-MGL2 maintains brain homeostasis.
- 论文链接:https://doi.org/10.1038/s41586-025-09477-y
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-10
- 期刊/会议:Nature
- 作者:Maximilian Frosch, Takashi Shimizu, Emile Wogram, ..., Marco Prinz
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
分享