Nature 重磅发现:揭开胰腺癌转移的“细胞共谋”,阻断这一蛋白或将逆转生存局
提起“癌王”胰腺癌,很多人的第一反应都是谈虎色变。作为一种致死率极高的恶性肿瘤,胰腺癌的五年相对生存率至今仍只有令人揪心的 13% 左右。绝大多数患者在确诊时,病情往往已经发展到了晚期,癌细胞不仅在原发部位肆虐,更已经悄悄转移到了肝脏、肺部等重要器官。
为什么胰腺癌如此难治?为什么它总是能轻易突破防线,发生远端转移?
长期以来,我们往往倾向于认为癌细胞是一群各自为战、疯狂繁殖的“独狼”。然而,最新的科学研究正在颠覆这一认知:胰腺癌细胞之间其实存在着严密的“组织分工”和“通讯网络”,它们像是一个训练有素的犯罪团伙,甚至懂得通过特定的“暗号”来互相掩护、共同作恶。
近日,国际顶级学术期刊《自然》(Nature)发表了一项突破性研究,科学家们不仅找到了维持这种“团伙作案”的关键信号蛋白——SPP1(骨桥蛋白),更在实验中证实:切断这个信号,就能打破癌细胞间的攻守同盟,从而显著抑制肿瘤的恶化与转移,大幅延长生存期。
这一发现,为我们攻克“癌王”提供了一个全新的战略支点。
1. 谁在幕后操纵?晚期患者血液中的“异常信号”
要解决胰腺癌转移的难题,首先得搞清楚:早期癌症和晚期癌症到底有什么不同?
为了解开这个谜题,研究人员做了一件非常直接的事情。他们收集了两组胰腺癌患者的血浆样本:一组是处于早期(I 期或 II 期)的患者,另一组则是处于晚期(III 期或 IV 期)的患者。通过对这两组样本中的蛋白质进行地毯式的搜索和对比分析,一个明显的差异浮出水面。
如图[1]所示,研究人员利用高精度的质谱分析技术,绘制出了一张详尽的蛋白质图谱。结果显示,在晚期胰腺癌患者的血液中,一种名为 SPP1(Secreted Phosphoprotein 1,也常被称为 Osteopontin,骨桥蛋白)的蛋白质水平出现了异常显著的升高。

不仅如此,研究人员在经典的胰腺癌小鼠模型(KPCY 小鼠)中也观察到了同样的现象:随着肿瘤的进展,小鼠血浆中的 SPP1 水平也随之飙升。这一发现迅速锁定了 SPP1 这个“嫌疑人”——它很可能就是推动胰腺癌从早期向晚期恶化、甚至发生转移的关键推手。
但是,SPP1 到底在癌细胞内部扮演了什么角色?它是单独行动,还是有同伙?
2. 癌细胞的“双面人生”:上皮细胞与间充质细胞的共谋
要理解 SPP1 的作用,我们必须先了解胰腺癌内部的一个重要特征:细胞的异质性。
简单来说,胰腺癌肿瘤并不是由一种单一的癌细胞组成的,而是混杂着不同“性格”的细胞亚群。其中最主要的两类是:
- 上皮样癌细胞(EPCs):它们保持着上皮细胞的特性,通常聚集在一起,形成肿瘤的主体结构。
- 间充质样癌细胞(MPCs):这类细胞更具侵略性,它们不仅获得了更强的移动能力,还是导致肿瘤耐药、复发和转移的“急先锋”。这种从上皮状态向间充质状态转化的过程(即 EMT),是癌症恶化的核心机制之一。
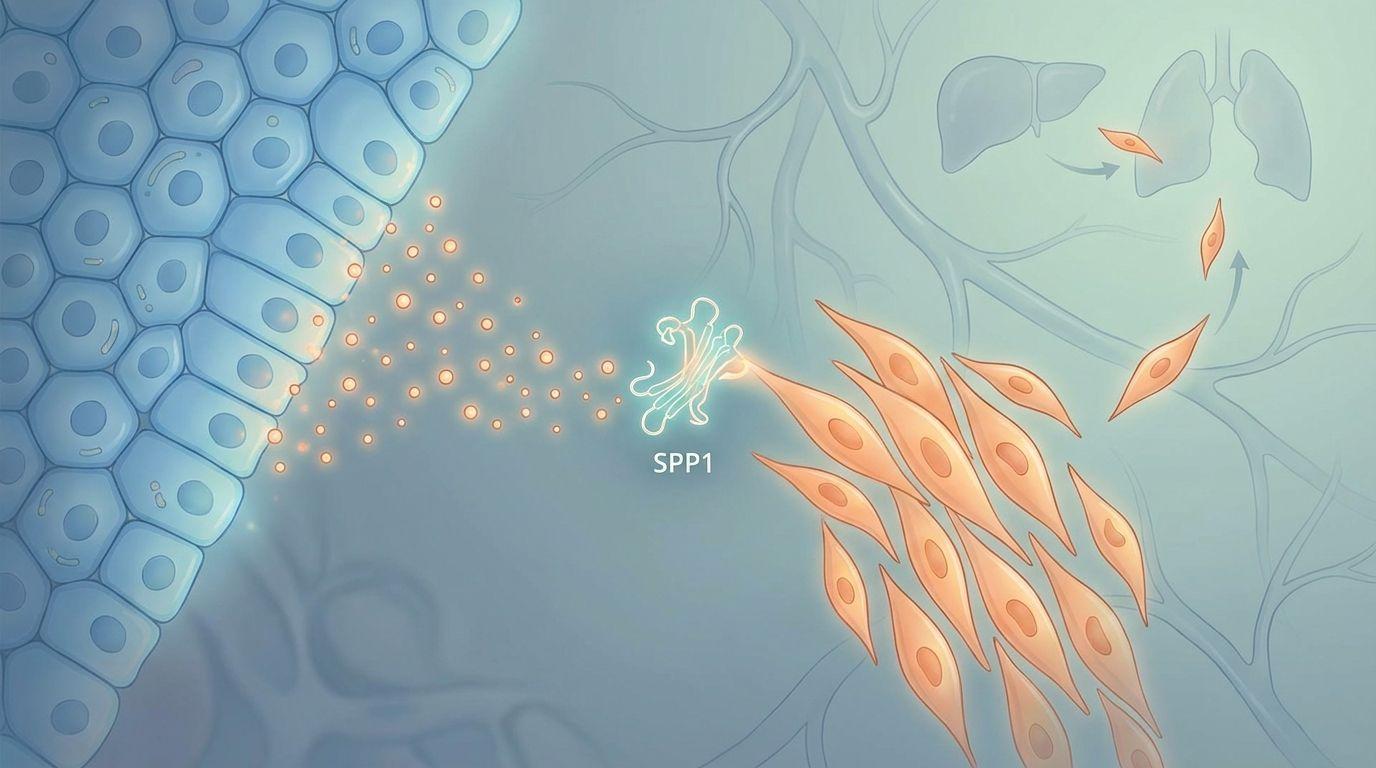
在大数据分析的支持下,研究团队发现了一个有趣的现象:那些 SPP1 表达量高的癌细胞群体,同时也表现出了强烈的间充质特性(EMT 特征)。更有意思的是,SPP1 并不是由这些凶猛的间充质细胞自己产生的,而是由“看似老实”的上皮样癌细胞分泌的。
这就构成了一幅令人细思极恐的画面:
如图[2]所示,在显微镜下,我们可以清晰地看到,绿色的 SPP1 蛋白主要富集在上皮样癌细胞区域,而红色的 CD61 受体则主要出现在间充质样癌细胞上。这两类细胞通过 SPP1 这个“信使”建立了紧密的联系。

上皮样癌细胞(EPCs)负责生产并分泌 SPP1,而间充质样癌细胞(MPCs)则通过表面的受体(CD61)来接收这个信号。 正是这种“你发信号、我接收”的通讯机制,维持了间充质样癌细胞的恶性状态,让它们能够持续存在并引发转移。
2.1 恶性闭环:一个完美的互助陷阱
这还不是故事的全部。研究团队进一步深挖发现,间充质样癌细胞(MPCs)在接收到 SPP1 的“指令”后,绝不仅仅是独善其身,它们还会“投桃报李”。
MPCs 被激活后,会启动细胞内的 NF-κB 信号通路,进而大量生产另一种名为 GREM1 的蛋白质。这个 GREM1 同样是个关键角色,它会被分泌出来,反过来作用于上皮样癌细胞(EPCs)。
这就形成了一个精密的恶性循环:
- EPCs 分泌 SPP1 激活 MPCs;
- MPCs 分泌 GREM1 保护 EPCs 免受 BMP 信号(一种会抑制 SPP1 表达的信号)的影响,从而确保 EPCs 能持续不断地生产 SPP1。
如图[3]所示,这两个细胞亚群通过 SPP1 和 GREM1 这两种信号分子,建立了一个相互依赖、互为因果的生态系统。正是这种牢不可破的“共谋”关系,维持了胰腺癌的高度异质性和侵袭性,让单一的治疗手段难以奏效。

3. 绝地反击:切断信号,癌细胞溃不成军
既然搞清楚了癌细胞之间联络的“电话线”,那么如果我们强行剪断它,会发生什么?实验结果令人振奋。
研究人员构建了特定的小鼠模型,通过基因编辑技术敲除了癌细胞中的 Spp1 基因,模拟了“切断通讯”的治疗场景。结果发现,失去了 SPP1 信号的维持,那些凶猛的间充质样癌细胞(MPCs)竟然无法维持其特性,转而变回了相对温和的上皮样状态,或者直接消失了。
更直观的改变体现在生存率和转移情况上:
- 生存期显著延长:如图[4]e和f所示,代表 Spp1 敲除组(Spp1 fl/fl,在这两张图中均为蓝线)的生存曲线显著优于对照组(Spp1 WT/WT,红线)。可以明显看到,蓝线大幅度向右平移,这意味着切断 SPP1 信号后,小鼠的生存时间得到了惊人的提升,部分小鼠甚至存活了超过 400 天,这在原本致死极快的胰腺癌模型中简直是奇迹。

- 转移被“清零”:最让人惊喜的结果出现在对远端器官的检查中。通常情况下,胰腺癌极易转移至肝脏和肺部。从图[4]g中我们可以看到,普通患癌小鼠的肝脏上布满了白色的转移结节(白色箭头所示),触目惊心;而敲除了 Spp1 的小鼠肝脏则光滑红润,几乎没有发现任何转移灶。统计数据(图[4]h和i)进一步证实,在阻断 SPP1 后,肝脏和肺部的转移发生率降到了极低水平。
这一结果有力地证明:SPP1 不仅是维持胰腺癌恶性程度的基石,更是驱动其致命转移的核心引擎。
4. 拆解“犯罪团伙”,重塑治疗格局
这项发表于《自然》杂志的重磅研究,为我们理解胰腺癌的顽固性提供了全新的视角。它告诉我们,肿瘤不仅仅是一堆失控细胞的堆积,更是一个有组织、有分工、有通讯的复杂生态系统。
长期以来,我们的化疗药物往往致力于直接杀伤快速分裂的癌细胞,却忽视了细胞间这种互补互助的生存机制。这也是为什么很多患者在化疗初期有效,但很快就会出现耐药和复发的原因——因为维持肿瘤恶性状态的“通讯网络”依然存在。
现在的发现为我们指明了一条新路:与其费力地去追杀每一个单打独斗的癌细胞,不如釜底抽薪,切断它们之间的通讯网络,让这个“犯罪团伙”因内部分裂而瓦解。
目前,针对 SPP1 或其受体 CD61 的抗体药物研发已经具备了坚实的理论基础。或许在不久的将来,通过联合使用这种新型的“通讯阻断剂”,我们终将能改写胰腺癌“确诊即晚期”的绝望剧本,为患者争取到宝贵的生存时间。
论文信息
- 标题:SPP1 is required for maintaining mesenchymal cell fate in pancreatic cancer.
- 论文链接:https://doi.org/10.1038/s41586-025-09574-y
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-9-24
- 期刊/会议:Nature
- 作者:Huafu Li, Linxiang Lan, Hengxing Chen, ..., Axel Behrens
本文由超能文献“资讯AI智能体”基于4000万篇Pubmed文献自主选题与撰写,并经AI核查及编辑团队二次人工审校。内容仅供学术交流参考,不代表任何医学建议。
分享



