
STTT顶刊:靶向USP5切断食管鳞癌供血,联合化疗显著抑瘤
食管鳞状细胞癌(ESCC)是中国最常见的消化道恶性肿瘤之一,以其高侵袭性和不良预后著称。面对这一“健康杀手”,目前的治疗手段仍然捉襟见肘,患者的生存率亟待提升。科学家们长期关注Notch信号通路在食管鳞癌中的表现,却面临着一个棘手的“悖论”:在正常的食管上皮中,NOTCH1突变似乎驱动了克隆扩增;而在肿瘤组织中,Notch信号又表现出过度激活的状态。这一通路究竟是敌是友?它又是如何影响肿瘤微环境的?
近日,来自中国医学科学院肿瘤医院的研究团队在权威期刊《Signal Transduction and Targeted Therapy》上发表了题为“Aberrant Notch-signaling promotes tumor angiogenesis in esophageal squamous-cell carcinoma”的研究成果。该研究揭示了Notch信号通路通过一种全新的机制——“NOTCH1-USP5-STAT3轴”,直接驱动了肿瘤的血管生成,并提出靶向去泛素化酶USP5联合化疗的治疗新策略,为食管鳞癌的临床治疗撕开了一道曙光。
1. 拨开迷雾:Notch信号与“血管生成”的危险共谋
在肿瘤的发生发展过程中,血管生成(Angiogenesis)扮演着至关重要的角色。肿瘤细胞为了维持其快速生长所需的氧气和营养,会像贪婪的掠夺者一样,诱导周围环境生出新的血管。在食管鳞癌中,血管生成尤为显著,且与肿瘤的恶性程度及患者的短生存期密切相关。
研究团队首先通过分析单细胞RNA测序数据,发现了一个引人注目的现象:在食管鳞癌的上皮细胞中,Notch信号通路的评分与血管生成通路呈显著正相关。
为了验证这一发现,研究人员对大量临床样本进行了多重免疫荧光分析。如图[1]所示,研究者将样本分为NICD1(Notch激活的标志物)高表达组和低表达组。从图中可以清晰地看到,NICD1的高表达(红色荧光)与CD31标记的血管内皮细胞密度(绿色荧光)呈现出惊人的一致性。统计分析进一步证实,Notch信号激活程度越高的肿瘤,其微血管密度越大,且多见于晚期(TNM III/IV期)及伴有淋巴结转移的病例。更令人担忧的是,高NICD1水平的患者,其生存时间显著短于低水平患者。
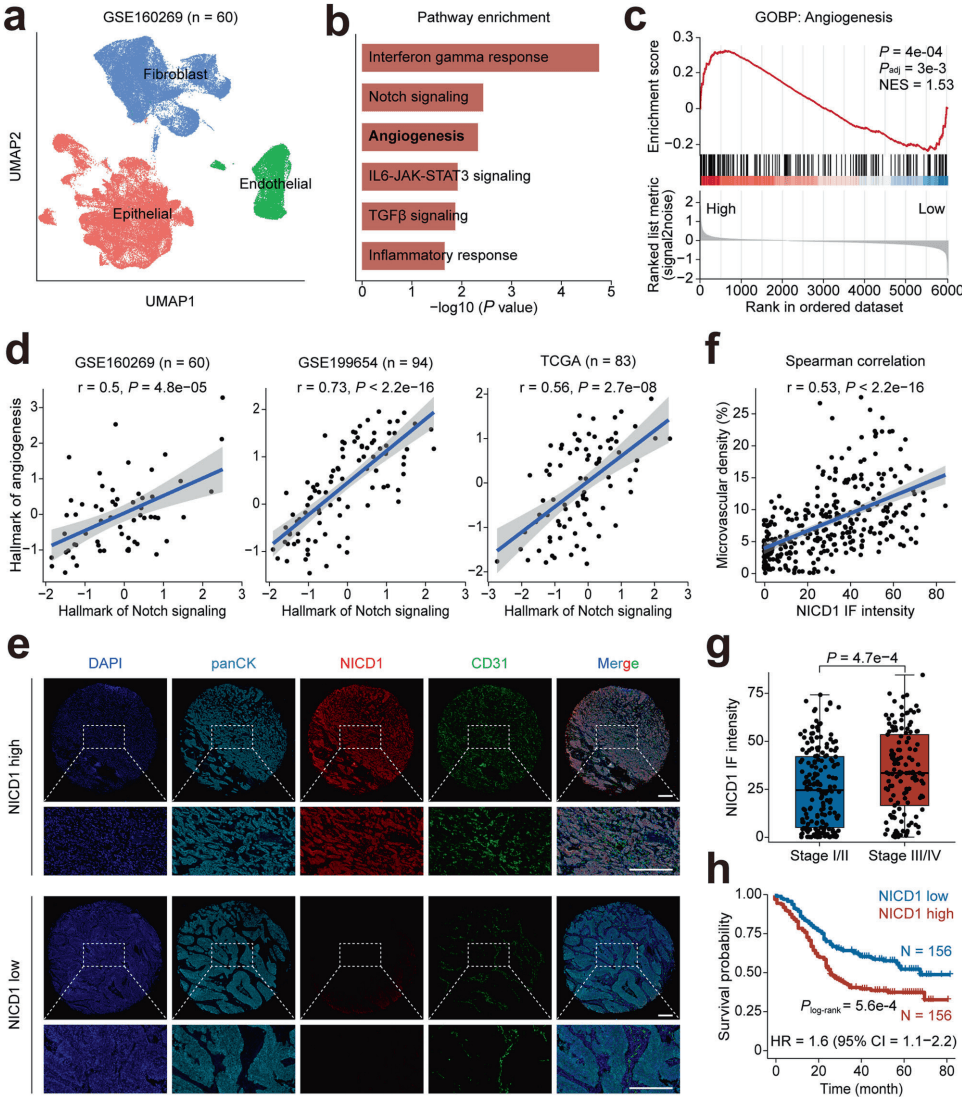
这些数据强有力地提示:异常激活的Notch信号并非旁观者,而是食管鳞癌血管生成的幕后推手。
2. 机制解码:USP5——连接Notch与血管生成的关键桥梁
既然确定了Notch信号是“幕后推手”,那么它究竟通过什么手段来指挥血管生成?既往研究常将目光投向缺氧诱导因子(HIF)通路,但本研究却意外发现,Notch对血管生成的促进作用并不依赖于HIF。
为了寻找真正的下游执行者,研究团队利用CUT&Tag技术和RNA测序技术进行了联合分析。他们寻找的是那些既在启动子区域有NICD1结合信号,又在敲除NOTCH1后表达量下降的基因。
如图[2]所示,筛选结果将目标锁定在了USP5(泛素特异性蛋白酶5)上。在基因组图谱中,NICD1在USP5的启动子区域有明显的富集峰,这意味着NICD1能够直接结合在USP5的启动子上。进一步的生化实验证实,NICD1入核后与RBPJ形成转录复合物,直接启动了USP5基因的转录表达。简单来说,Notch信号一旦激活,就会像按下开关一样,大量制造USP5这种酶。
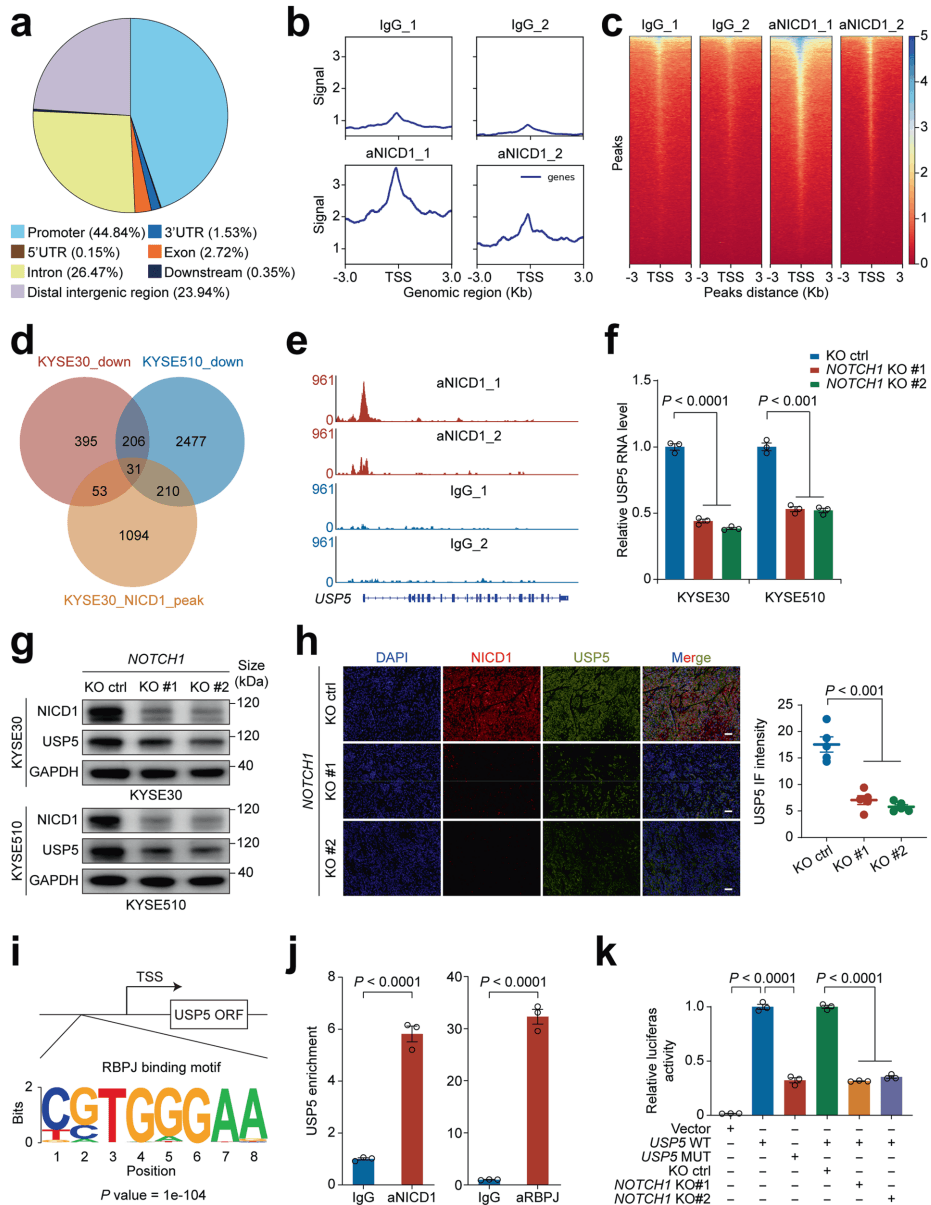
3. 效用放大:USP5如何通过STAT3“点燃”血管生成
USP5作为一种去泛素化酶,其本职工作是修饰蛋白质,防止它们被降解。那么,被USP5“保护”的究竟是谁?
研究团队将目光投向了JAK-STAT信号通路中的核心分子——STAT3。STAT3已知是血管生成的关键调节因子,但在本研究中,其与Notch通路的联系被精确地描绘出来。
如图[3]所示,研究人员通过免疫共沉淀等实验发现,USP5与STAT3在细胞内存在直接的相互作用(图h/i)。更关键的是,USP5通过移除STAT3蛋白上特定的K48连接的泛素链(图j),从而阻止了STAT3被蛋白酶体降解。这就像给STAT3穿上了一件“防弹衣”,使其在细胞内的稳定性和半衰期显著增加。
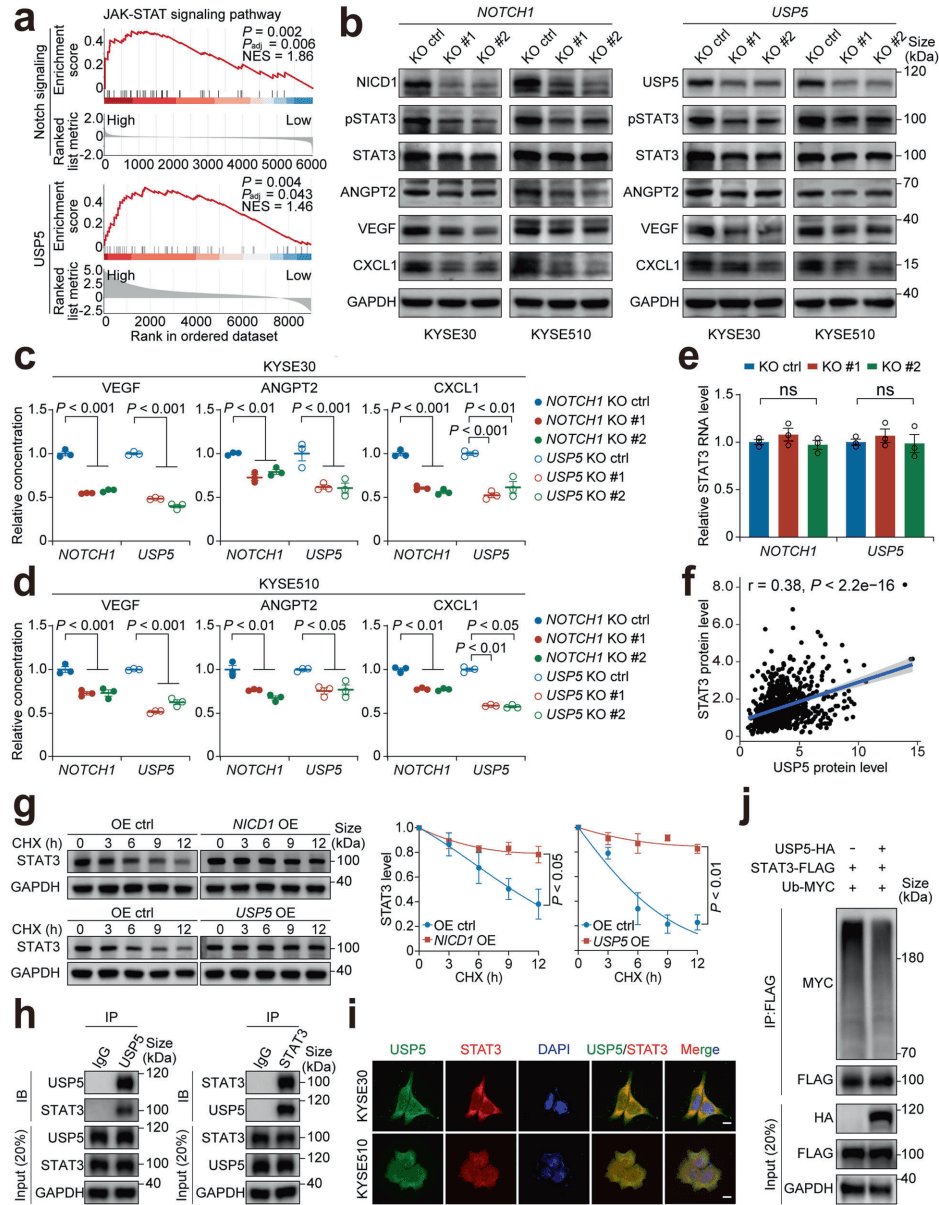
被USP5“救下”的STAT3并未闲着,它积累后磷酸化水平随之升高,进而入核促进下游促血管生成因子(如VEGF、ANGPT2和CXCL1)的转录和分泌。这些因子被释放到肿瘤微环境中,就像发出的“集结号”,诱导血管内皮细胞迁移和成管,最终形成滋养肿瘤的血管网络。
4. 临床转化:靶向USP5联合化疗的治疗潜力
既然明确了“NOTCH1-USP5-STAT3”这一轴线是罪魁祸首,那么阻断其中任何一环,是否就能遏制肿瘤生长?鉴于直接抑制Notch通路常带来严重的副作用,研究人员将目光锁定在下游的USP5上,使用了一种名为EOAI3402143的USP5抑制剂。
在小鼠移植瘤模型中,治疗效果令人振奋。如图[4]所示,对于过表达NICD1的肿瘤(这类肿瘤通常生长迅速且血管丰富),单用USP5抑制剂EOAI3402143就能显著抑制其生长,且肿瘤内的微血管密度大幅下降(图c)。
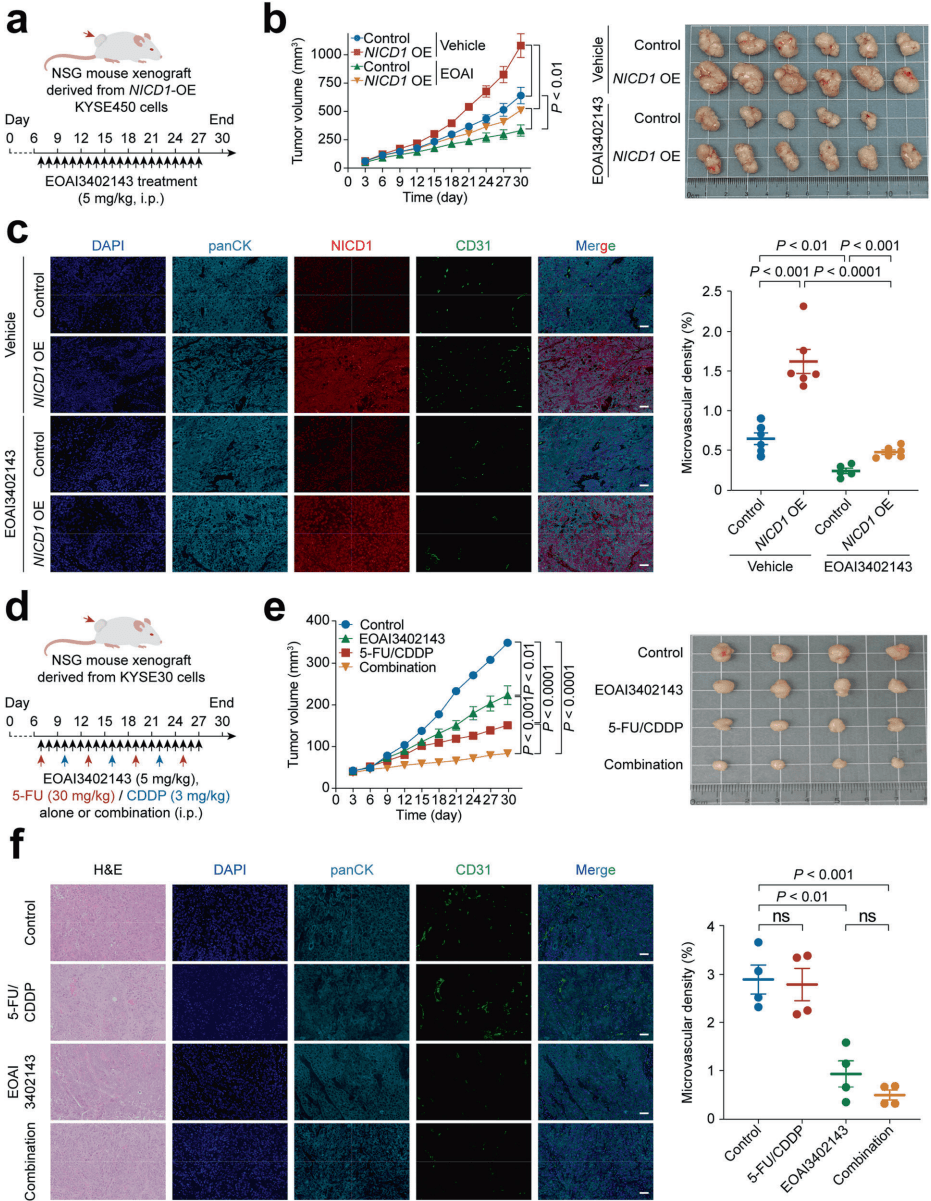
更具临床指导意义的是,研究人员模拟了临床常用的化疗场景。如图[4]中的图e和f所示,当USP5抑制剂与传统的化疗药物(5-氟尿嘧啶/顺铂)联合使用时,展现出了“1+1>2”的协同抗癌效果。联合治疗组的肿瘤体积最小,且血管密度被压制到最低水平。这表明,阻断USP5不仅能切断肿瘤的“补给线”,还能增强化疗药物的杀伤力。
5. 展望
本研究完整地勾勒出了一幅食管鳞癌血管生成的分子图谱:
如图[5]所示,在食管鳞癌细胞中,异常激活的Notch信号促使NICD1入核,诱导USP5表达;USP5进而去泛素化并稳定STAT3;累积的STAT3最终促进VEGF等因子的分泌,诱导血管生成,加速肿瘤进展。

这一发现不仅解释了为什么食管鳞癌中Notch信号虽有突变但功能依然活跃的谜题,更为临床治疗提供了新的靶点。在未来,针对USP5的靶向药物有望成为抗血管生成治疗的新利器,特别是与现有化疗方案的联用,或许能为晚期食管鳞癌患者带来更长的生存获益。
论文信息
- 标题:Aberrant Notch-signaling promotes tumor angiogenesis in esophageal squamous-cell carcinoma.
- 论文链接:https://doi.org/10.1038/s41392-025-02309-5
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-7-22
- 期刊/会议:Signal transduction and targeted therapy
- 作者:Cainan Li, Pujie Wu, Xiaoting Xie, ..., Chen Wu
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
分享




