
欧洲心脏杂志重磅:32万人大数据揭示“致命三重奏”,三大指标叠加让心血管风险激增77%
在心血管健康的维护中,低密度脂蛋白胆固醇(LDL-C)长期占据着“头号公敌”的位置,也就是我们俗称的“坏胆固醇”。大多数人的体检单和治疗方案都围绕着它展开:他汀类药物的使用、饮食的控制,目标似乎只有一个——把LDL-C降下来。
然而,临床上存在一个令人困惑的现象:许多患者的LDL-C已经控制得很好,却依然发生了心梗或卒中。这种在标准治疗下依然存在的风险,被称为“心血管剩余风险”。
这部分风险究竟藏在哪里?
近日,发表在心血管领域顶级期刊《欧洲心脏杂志》(European Heart Journal)上的一项重磅研究,通过对超过32万名参与者长达14年的追踪,为我们揭示了答案。研究发现,除了LDL-C,脂蛋白(a) [Lp(a)] 和 高敏C反应蛋白 (Hs-CRP) 也是独立且强效的风险预测因子。当这三大指标同时异常时,它们构成的“致命三重奏”将产生可怕的协同效应,使心血管事件的风险激增。
1. 它是谁?被忽视的“剩余风险”拼图
这项由德国格赖夫斯瓦尔德大学医学中心主导的研究,基于著名的英国生物样本库(UK Biobank)数据,纳入了322,922名此前没有心血管疾病史的参与者(女性占比55.9%),中位随访时间长达13.7年。这种规模的前瞻性队列研究,为结论的可靠性提供了坚实的数据背书。
在深入解读数据之前,我们需要先重新认识一下这三个主角,它们在血管中扮演着截然不同却又狼狈为奸的角色:
- LDL-C(低密度脂蛋白胆固醇):老牌反派。它像运送垃圾的卡车,容易在血管壁上沉积,形成斑块的核心。
- Lp(a)(脂蛋白(a)):遗传的“幽灵”。它的结构类似LDL,但多了一个“小尾巴”(载脂蛋白(a))。这个结构让它不仅能像LDL一样促进斑块形成,还具有促炎和促血栓的特性。更重要的是,Lp(a)水平主要由基因决定,很难通过饮食运动改变,且常规他汀类药物对其几乎无效。
- Hs-CRP(高敏C反应蛋白):发炎的“信号弹”。它不是胆固醇,而是反映体内低度炎症水平的标志物。动脉粥样硬化本质上是一种慢性炎症反应,Hs-CRP升高意味着血管壁正如火如荼地进行着破坏活动。
研究的核心问题非常直接:这三个指标,究竟是各自为战,还是联手作恶?
2. 协同效应:当“坏胆固醇”遇上“炎症风暴”
该研究最震撼的发现在于揭示了这三种生物标志物的协同效应。也就是说,当它们同时升高时,风险的增加不是简单的“1+1+1”,而是一种倍增关系。
为了直观地理解这一点,我们可以看一张极具信息量的图表。如图[1]所示,这是该研究的结构化摘要图,左侧展示了研究设计,纳入了超过32万名参与者,并根据是否服用降脂药物进行了分层。而右侧的生存曲线图则生动地展示了不同风险组的命运分野。

从图[1]的右侧图表中,我们可以清晰地解读出几个关键信息:
- 基准线(蓝色线):代表“三低人群”(LDL-C、Lp(a)、Hs-CRP均处于低水平),他们的心血管事件累积发生率最低,线条平缓。
- 最高风险线(黑色线):代表“三高人群”(三个指标同时升高),这条线陡峭上升,与其下方的线条拉开了显著的距离。
- 关键数据:在未使用降脂药物的人群中(图A),相比于“三低”人群,“三高”人群发生主要不良心血管事件(MACEs)的风险增加了77%。即便是在使用降脂药物的人群中(图B),这一风险依然高出58%。
这张图有力地支撑了研究者的观点:仅关注LDL-C是远远不够的。Lp(a)带来的遗传风险和Hs-CRP代表的炎症环境,正在“暗度陈仓”,显著推高心血管事件的发生率。
3. 既然吃了药,为何风险依然存在?
很多人认为,“我吃了他汀,血脂正常了,就万事大吉了”。这项研究给了这种乐观心态一记警钟。
数据显示,在服用降脂药物(如他汀)的人群中,虽然LDL-C可能得到了控制,但如果Lp(a)或Hs-CRP依然维持高位,剩余风险依然巨大。事实上,服用降脂药人群的心血管事件发生率(18.6%)显著高于未服药人群(8.32%)。这并非药物无效,而是因为服药人群本身就是高龄、肥胖、高血压或糖尿病等高危因素集中的群体(这也符合临床实际)。
在这种高危背景下,多指标的异常显得尤为致命。
如图[2]所示,我们能看到长达16年的累积发病率曲线。请注意观察图B(服用降脂药物组):
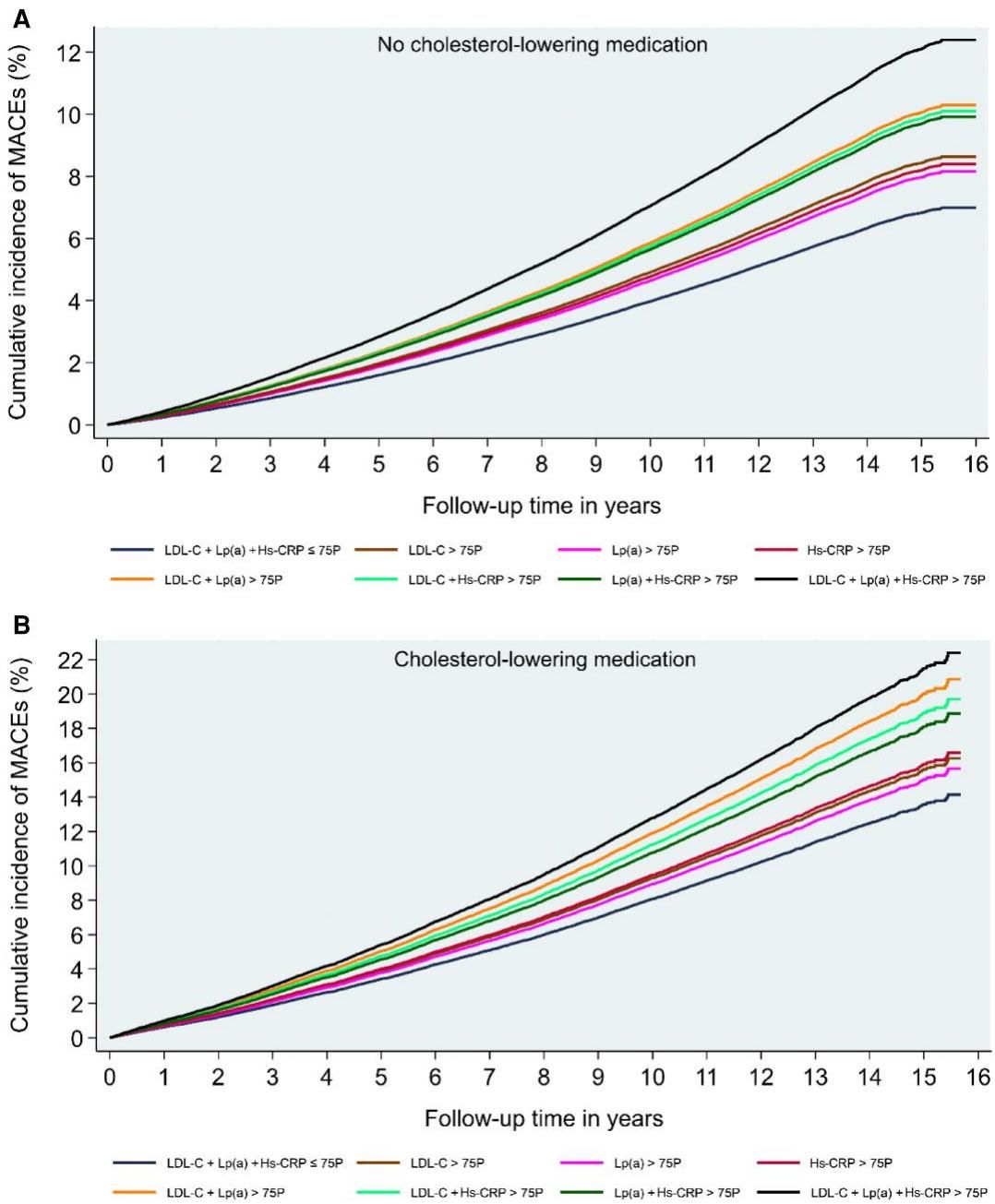
从图[2]中可以看到,随着时间的推移,两条曲线的开口越来越大,像一把张开的剪刀。这说明风险的累积是长期的,如果我们忽视了Lp(a)和炎症的管理,时间越久,我们要付出的健康代价就越惨重。这也提示临床医生,对于已经接受治疗的患者,不能只盯着LDL-C这一项指标,必须进行更全面的风险评估。
4. 精准量化:风险是如何层层加码的?
为了更精准地量化这种协同风险,研究人员对数据进行了深度剖析,计算了不同生物标志物组合下的风险比(Hazard Ratio, HR)。
如图[3]所示,这是一张展示不同风险分组相对危险度的森林图。图中清晰地呈现了从“单一指标异常”到“三重指标异常”,心血管事件风险是如何像滚雪球一样层层加码的。
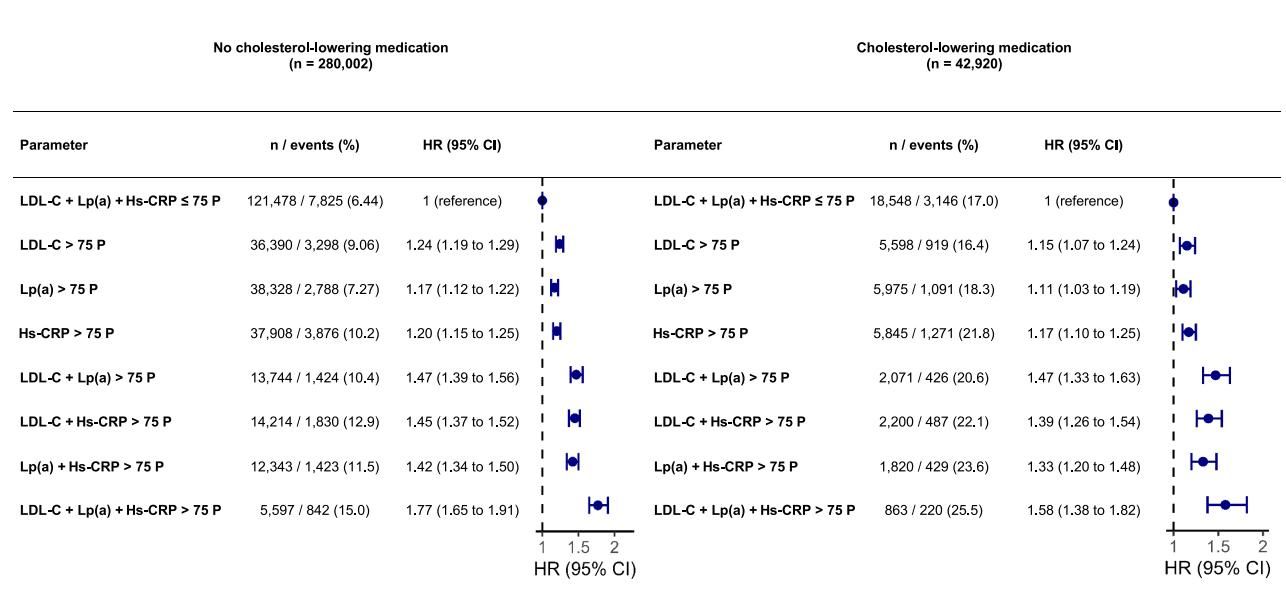
让我们聚焦于图[3]左侧的“未服用降脂药物”人群:
- 单一指标升高:当仅有LDL-C、Hs-CRP或Lp(a)其中一项升高(超过75百分位)时,心血管事件风险分别增加了24%、20%和17%。此时,风险虽然增加,但尚在可控范围。
- 双重打击:当任意两个指标同时升高时,风险比迅速攀升至1.45左右,意味着风险增加了近50%。
- 致命三重奏:最下方的一行数据令人触目惊心——当LDL-C、Lp(a)和Hs-CRP同时升高时,风险比达到了1.77(95% CI: 1.65-1.91)。这意味着,与三项指标均正常的人相比,这部分人群发生心血管灾难的概率增加了整整77%。
即使在图[3]右侧的“服用降脂药物”人群中,这种趋势依然稳固。虽然药物压制了部分风险,但“三高”人群的相对风险依然增加了58%。这有力地证明了Lp(a)和Hs-CRP是独立于LDL-C之外的“漏网之鱼”,现有的标准治疗方案往往未能覆盖这些风险盲区。
5. 未来已来:“三联疗法”或将重塑防线
这项涉及32万人的大规模研究,不仅解释了困扰医生已久的“剩余风险”之谜,更为未来的心血管预防指明了新方向:从单一的“降胆固醇”,转向“降脂+降Lp(a)+抗炎”的立体防御体系。
这一理念正在逐步从实验室走向临床:
- 抗炎治疗:已有临床试验证实,使用抗炎药物(如卡纳单抗、秋水仙碱)可以降低心血管事件风险,且不依赖于降脂效果。
- Lp(a)靶向药:虽然目前尚无获批的专门降低Lp(a)的药物,但基于反义寡核苷酸(ASO)和干扰RNA(siRNA)技术的新药正在进行临床试验,有望在未来几年填补这一空白。
给您的健康建议(Take Home Message):
- 打破“只看胆固醇”的惯性:在下一次体检中,除了常规血脂四项,建议额外关注高敏C反应蛋白(Hs-CRP),这是捕捉血管隐性炎症的关键。
- 及早进行Lp(a)检测:研究明确指出,早期评估Lp(a)、LDL-C和Hs-CRP水平,能有效识别出那些可能从早期药物干预中获益的人群。由于Lp(a)具有强遗传性,早期筛查对于长期预防动脉血栓事件至关重要。
- 关注生活方式与综合干预:如果你发现自己属于多指标异常的高危人群,即便目前没有症状,也应更积极地改善生活方式,并与医生探讨是否需要更强效的综合预防措施。
心血管疾病的防控,正在经历一场从粗放管理到精准打击的变革。当我们不再只盯着LDL-C这一座冰山,而是看清海面下的Lp(a)暗礁和炎症暗流时,我们离战胜这个“人类头号杀手”的目标,或许又近了一步。
论文信息
- 标题:Low-density lipoprotein cholesterol, lipoprotein(a) and high-sensitivity C-reactive protein are independent predictors of cardiovascular events.
- 论文链接:https://doi.org/10.1093/eurheartj/ehaf281
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-10-14
- 期刊/会议:European heart journal
- 作者:Marcello Ricardo Paulista Markus, Till Ittermann, Joany Mariño Coronado, ..., Marcus Dörr
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
分享



