无药可治的败血症有救了?新研究锁定细胞“铁死亡”,有望逆转多器官衰竭
1. 全球每年1100万人因此丧生,现代医学为何束手无策?
你可能听说过“败血症”(Sepsis),但你也许不知道它有多凶险。这并不是一种简单的细菌感染,而是身体对感染做出的“失控反应”。想象一下,为了抓一个小偷(病菌),警察(免疫系统)竟然放火烧掉了整栋大楼(身体器官)。
据统计,全球每年约有5000万败血症病例,导致约1100万人死亡。这是一个惊人的数字,意味着在你看完这句话的几秒钟里,世界上可能就有一人因此离世。即便是在医疗技术高度发达的今天,败血症依然是重症监护室(ICU)里的头号杀手。
为什么它这么难治?
目前的治疗手段主要是抗生素(杀菌)和器官支持(呼吸机、透析等)。但医生们发现一个令人绝望的现象:即便病菌被杀死了,病人的器官衰竭往往还在继续,甚至愈演愈烈。这说明,我们漏掉了某个关键的“幕后推手”。
传统的观点认为,是过度的炎症风暴摧毁了身体。然而,最新的科学研究指向了一个全新的方向——一种被称为“铁死亡”(Ferroptosis)的特殊细胞死亡方式。这不是普通的细胞衰老,而是一场发生在细胞内部的、剧烈的“化学爆炸”。
2. 细胞也会“生锈”?揭秘致命的铁死亡
要理解为什么败血症会引发多器官衰竭,我们必须先看看细胞里到底发生了什么。
我们都知道,铁是人体必需的元素,比如红细胞需要铁来运输氧气。但是,铁是一把双刃剑。在败血症的病理环境下,细胞内的铁代谢会发生严重紊乱。
简单来说,铁死亡就是细胞“生锈”至死的过程。
当病菌入侵时,人体为了限制病菌生长(病菌也需要铁),会试图把铁“锁”在细胞里。但这导致了细胞内铁严重超载。这些多余的游离铁,就像散落在充满油气房间里的火星,一旦遇到细胞膜上的多不饱和脂肪酸(PUFAs),就会通过芬顿反应(Fenton reaction)引发剧烈的脂质过氧化。
这还不是最糟的。正常情况下,细胞里有一个名为 GPX4 的“消防队长”,它能及时清除这些过氧化物。但在败血症中,这个防御系统失效了。于是,细胞膜被氧化破坏,细胞最终“甚至来不及告别”就走向了崩解。
为了更直观地理解这个微观过程,我们来看一张详细的机制图。
如图[1]所示,细胞发生铁死亡的过程主要由三股力量交织而成。首先,请看左侧的“启动”部分(Initiating ferroptosis),细胞内的铁严重超载,过量的二价铁离子(Fe²⁺)通过芬顿反应(Fenton reaction)成为了灾难的导火索。接着看中间部分(Inducing ferroptosis),原本负责抗氧化的SLC7A11-GSH-GPX4防御系统被抑制或耗尽,这意味着细胞失去了自我保护的盾牌。最后看右侧的核心机制(Core mechanism),在由于缺乏保护而变得脆弱的细胞膜上,脂质过氧化反应失控,细胞膜最终破裂。这就好比一个装满炸药的仓库(脂质),不仅拆除了防火墙(GPX4失效),还扔进去了一根火柴(铁超载),结果必然是毁灭性的。

3. 独特的“死亡指纹”:如何辨别铁死亡?
既然铁死亡这么可怕,医生怎么知道病人的细胞是在经历这种特殊的死亡,而不是普通的凋亡或坏死呢?
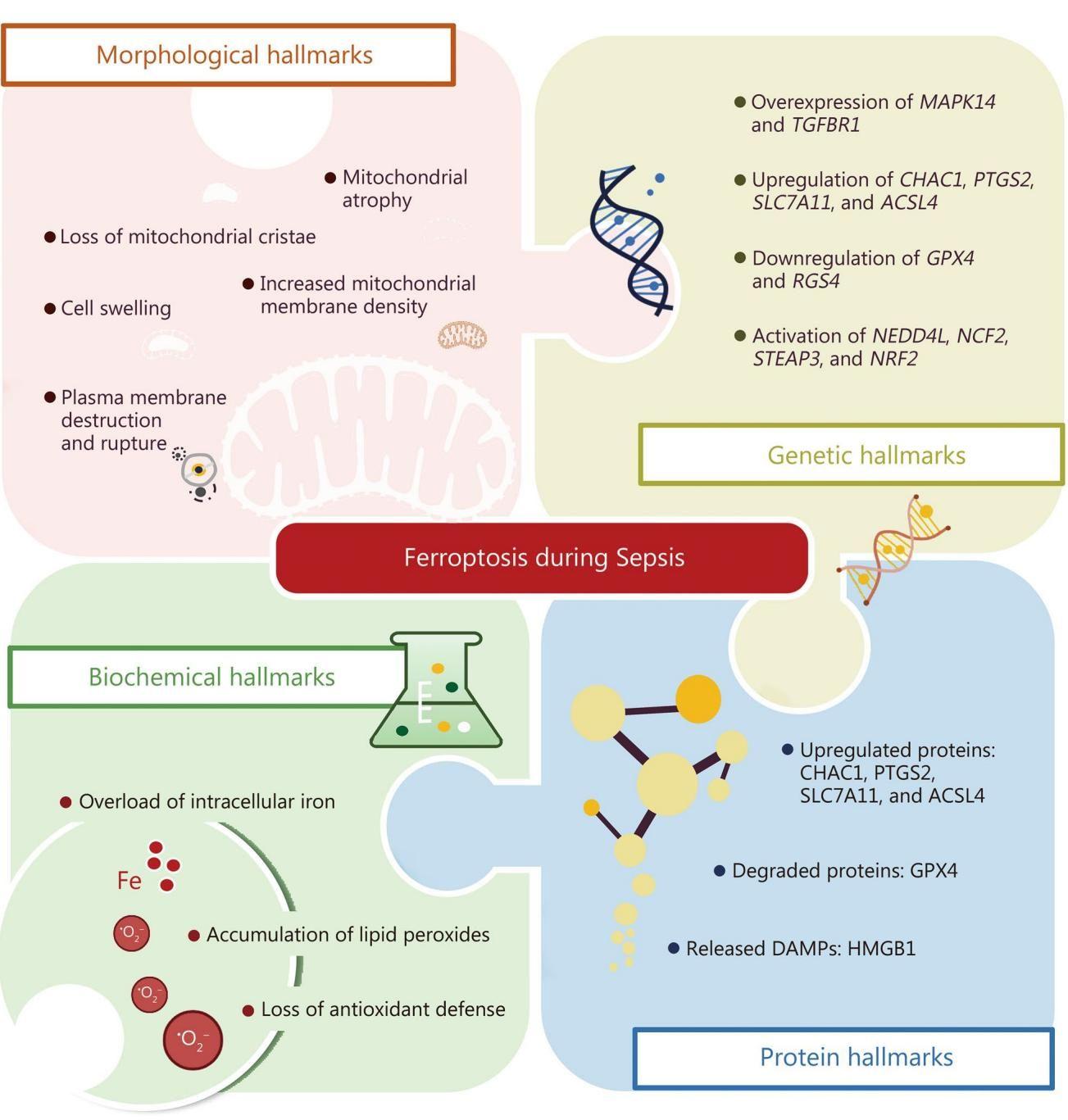
科学家们发现,铁死亡在显微镜下和基因层面都有着独特的“指纹”。如果你能深入到细胞内部,你会看到线粒体——细胞的能量工厂——发生了惊人的变化。
如图[2]所示,铁死亡展现出了非常特异性的标志。请注意左上角的形态学特征(Morphological hallmarks),发生铁死亡的细胞中,线粒体会发生萎缩,原本清晰的线粒体嵴(cristae)消失了,膜密度增加,甚至发生细胞肿胀和质膜破裂。这与我们常见的细胞肿胀或溶解截然不同。此外,从右侧的基因和生化层面看,与铁死亡相关的特定基因(如CHAC1、PTGS2等)表达量显著上升,而保护性蛋白GPX4则大幅减少。这些形态和生化上的改变,就像案发现场的指纹一样,帮助科学家们确认:正是铁死亡在败血症的器官损伤中扮演了关键角色。
这种细胞层面的崩溃,投射到整个人体上,就是我们害怕的灾难性后果。
4. 免疫崩塌与器官停摆:一场由铁死亡引发的多米诺骨牌效应
败血症最令人棘手的地方在于,它往往呈现出“冰火两重天”的极端状态:早期是免疫系统杀红了眼的“过度炎症”,晚期则是免疫系统全面瘫痪的“免疫抑制”。最新的研究表明,铁死亡恰恰是连接这两大极端状态的关键纽带,更是导致多器官衰竭的罪魁祸首。
首先,它是炎症风暴的“助燃剂”。 在败血症早期,巨噬细胞等免疫卫士因铁死亡而破裂,释放出大量的损伤相关分子模式(DAMPs),这就像是往火堆里泼了一桶油,瞬间引爆全身的剧烈炎症反应。
其次,它是免疫系统的“屠宰场”。 随着病情发展,铁死亡开始大量收割关键的免疫细胞,如T细胞和树突状细胞。这直接导致患者免疫功能“断崖式下跌”,不仅无法清除原有的病菌,还极易感染新的病菌(二次感染)。
最致命的是,它是器官衰竭的“推手”。 这场细胞层面的灾难并不仅限于免疫系统,它会迅速波及全身的重要脏器。
如图[3]所示,铁死亡就像处于风暴中心的“恶魔”,向左右两侧伸出了破坏之手。在左侧,它全面扰乱了败血症的免疫发病机制,包括破坏先天和适应性免疫、引发炎症风暴以及导致免疫抑制。而在右侧,其破坏力直接投射到了人体各大生命中枢:从大脑的认知障碍(脓毒症脑病)到肺部的呼吸衰竭(SA-ALI),从心脏的泵血无力到肝脏、肾脏以及肠道的损伤。可以说,凡是血液流经之处,铁死亡都可能诱发一场局部的器官功能崩溃。

5. 逆转危局:瞄准铁死亡的新疗法
既然找到了“铁死亡”这个幕后黑手,科学家们自然想到了对策:如果我们能阻止细胞“生锈”,是不是就能救回败血症患者的命?
目前,针对铁死亡的治疗策略已经展现出了令人振奋的潜力,这可能成为未来治疗败血症的“杀手锏”。
第一招:釜底抽薪(铁螯合剂)。 既然铁超载是祸根,那就用药物(如去铁胺)把多余的铁“抓”走,让它们无法参与破坏反应。这就像没收了纵火者的打火机。
第二招:筑起盾牌(抗氧化剂)。 使用特定的抑制剂(如Fer-1、Lip-1)直接阻断脂质过氧化过程,或者补充谷胱甘肽(GSH)来增强细胞自身的防御系统(GPX4)。这相当于给细胞穿上了一层防火服。
第三招:精准打击(纳米技术)。 为了减少药物副作用,科学家还在开发纳米粒子载药系统,试图将药物精准递送到受损的器官。
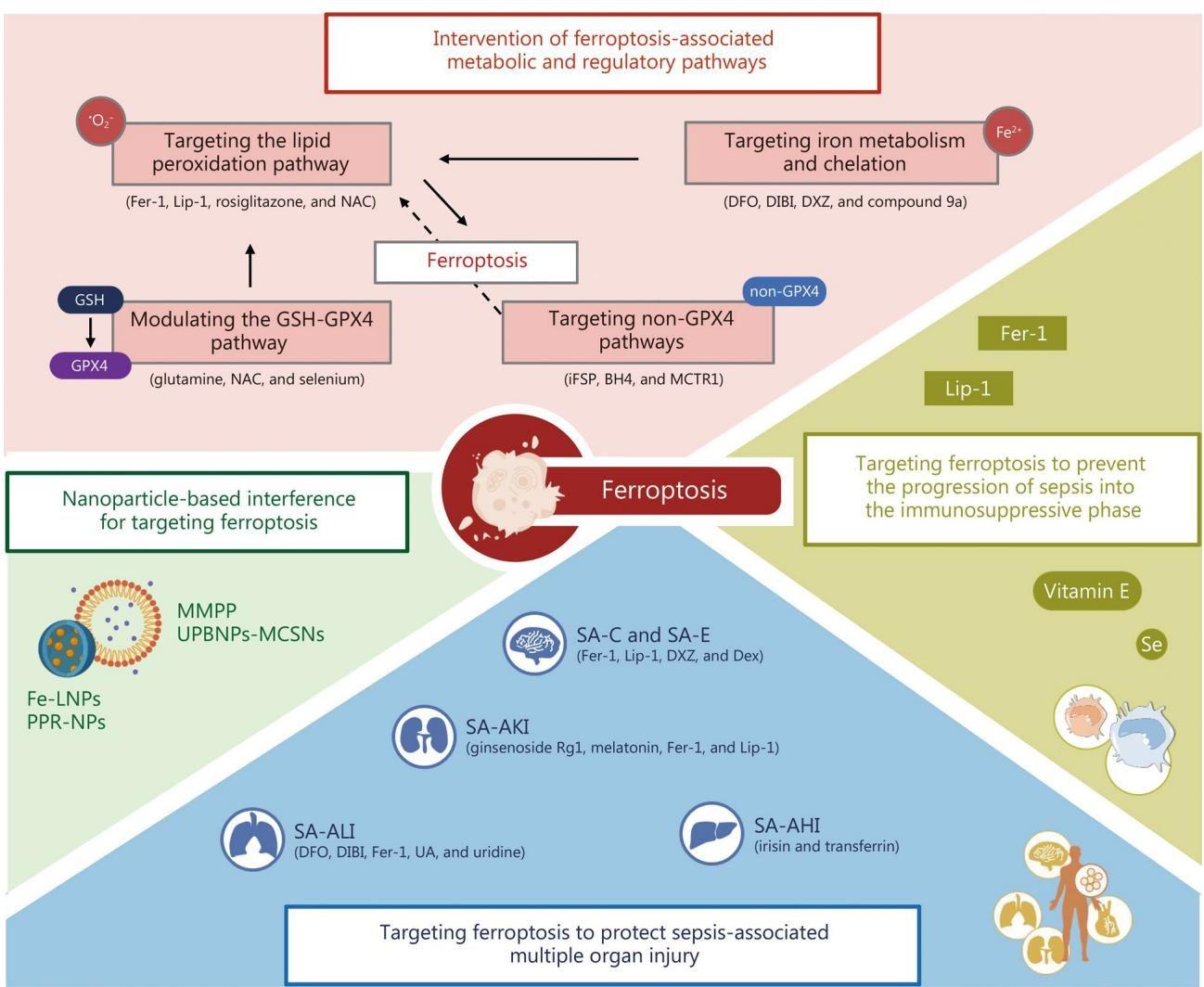
我们可以通过一张图来概览这些前沿的“作战计划”。
如图[4]所示,针对铁死亡的干预手段是全方位、多层次的。图的上半部分展示了从代谢通路入手的四大策略:直接阻断脂质过氧化(粉色框)、调节铁代谢(粉色框)、调节GSH-GPX4通路(粉色框)以及非GPX4通路。图的左下角展示了利用纳米粒子(如Fe-LNPs)进行精准干扰的新技术。而图的右下角则生动地描绘了这些疗法在临床上的最终目标:不仅要防止败血症滑向免疫抑制的深渊(黄色区域),更要精准保护心脏、大脑、肾脏、肺和肝脏等每一个受损的器官(蓝色/白色圆圈区域)。
6. 未来展望:距离临床应用还有多远?
虽然我们在实验室的小鼠身上看到了令人欣喜的结果——阻断铁死亡确实能显著提高生存率并减轻器官损伤,但要用到人类身上,还有一段路要走。
目前的挑战在于,很多铁死亡抑制剂在人体内的代谢速度太快,或者存在副作用。例如,著名的抑制剂Fer-1虽然效果好,但很难在体内稳定存在。此外,如何掌握好“度”也是个问题,毕竟适度的铁和氧化反应对人体正常的生理功能也是必要的。
结语
科学的每一步进展,都是在与死神赛跑。确认“铁死亡”在败血症中的核心地位,标志着我们对这一古老致死性疾病的认知迈出了革命性的一步。它不再是一个模糊的“炎症失控”,而是一个清晰的、可被干预的分子过程。随着新型药物和纳米递送技术的成熟,我们有理由相信,在不久的将来,医生手中将多出一张王牌,将无数生命从败血症导致的多器官衰竭边缘拉回来。
(注:本文解读基于最新科学文献,具体医疗方案请遵医嘱。)
论文信息
- 标题:The emerging role of ferroptosis in the pathological development and progression of sepsis.
- 论文链接:https://doi.org/10.1186/s40779-025-00665-5
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-11-18
- 期刊/会议:Military Medical Research
- 作者:Hui-Ting Zhou, Jie Huang, Ya-Kun Liu, ..., Jian Wang
本文由超能文献“资讯AI智能体”基于4000万篇Pubmed文献自主选题与撰写,并经AI核查及编辑团队二次人工审校。内容仅供学术交流参考,不代表任何医学建议。
分享