
Cell重磅:哈佛团队开发首款三价mRNA结核疫苗,保护力全面超越百年BCG
在抗击传染病的漫长战役中,结核病(TB)始终是一个沉默而可怕的对手。作为全球头号传染病杀手之一,它每年夺走超过百万人的生命。然而,人类对抗结核病的武器库却显得捉襟见肘——唯一的获批疫苗“卡介苗”(BCG)已问世百年,虽然对儿童重症结核有保护作用,但对青少年和成人的保护力却随着时间推移而断崖式下跌。
开发新型结核疫苗迫在眉睫,但科学界面临着一个巨大的认知黑箱:结核分枝杆菌拥有约4000个基因,究竟哪一个才是引发有效免疫反应的“阿喀琉斯之踵”?
近日,哈佛医学院贝斯以色列女执事医疗中心(BIDMC)的Dan H. Barouch团队在顶级期刊《Cell》上发表了题为“Mining the CD4 antigen repertoire for next-generation tuberculosis vaccines”的研究论文。这项研究不仅从数千个候选者中筛选出了全新的保护性抗原,更利用mRNA-LNP技术开发出了一款三价mRNA结核疫苗。令人振奋的是,该疫苗在小鼠模型中展现出了全面超越BCG的保护力,甚至能有效阻断细菌的感染和播散。这一突破性进展为终结结核病流行带来了新的曙光。
1. 大海捞针:从4000个候选者中锁定“特种兵”
结核疫苗研发之所以举步维艰,最大的痛点在于“选角难”。不同于病毒疫苗通常只需针对棘突蛋白等单一靶点,细菌的基因组庞大而复杂。以往的抗原选择往往依赖于经验或特定的功能假设(如分泌蛋白),缺乏系统性的筛选。
为了打破这一僵局,研究团队构建了一套从人体数据到小鼠验证的系统性筛选流水线。他们首先把目光投向了“潜伏性结核感染”(LTB)人群——这部分人群体内虽然有细菌,但免疫系统成功控制了病情,说明他们识别到了正确的抗原。
如图[1]所示,研究人员首先基于已发表的人类潜伏性结核CD4 T细胞抗原库,确定了潜在的候选目标。随后,他们构建了一个包含42种抗原的DNA疫苗文库,并在具有高度MHC II类分子多样性的CB6F1小鼠中进行了一一通过“初免-加强”免疫后,让小鼠通过气溶胶吸入结核分枝杆菌,最后通过检测肺部菌载量来“一考定终身”,直接评估每种抗原的保护效力。

这一筛选策略的核心在于“以保护力为金标准”。不是看谁产生的抗体多,也不是看谁诱导的细胞因子强,而是实打实地看谁能把肺里的细菌数量降下来。这种大规模的体内筛选,在结核疫苗研发领域尚属首次。
2. 意外发现:顶级抗原并非“当红炸子鸡”
筛选的结果出人意料,不仅揭示了抗原之间巨大的效力差异,更颠覆了许多既往的认知。
在测试的42种抗原中,研究团队发现了一个残酷的现实:目前正在临床试验阶段的热门候选抗原,表现并不突出。 在20种临床阶段的抗原中,只有25%显示出了超过1.5倍的保护力。相比之下,筛选出的前8名“优胜者”大多是尚未进入临床开发的“冷门”抗原。
从图[2]中我们可以清晰地看到这次“海选”的排名情况。图[2]A展示了各个抗原在减少肺部菌载量方面的表现,虚线以上的是表现优异的第一梯队(保护力≥2.5倍)。值得注意的是,著名的TB10.4(Rv0288)和Mtb32A(Rv0125)等临床明星抗原并未进入前列,而Rv1387、Rv0287、Rv1788等新面孔则脱颖而出。统计分析显示,这8种新型优选抗原的总体保护效力显著优于现有的临床抗原(图[2]B)。

进一步的分析发现,这8种顶级抗原并非杂乱无章,而是聚类在四个特定的家族中:PPE家族(如Rv1387)、Esx家族(如Rv0287)、PE家族(如Rv1788)和Ag85家族。更有趣的是,研究人员发现同一家族内的抗原虽然序列不同,但能诱导产生交叉反应的CD4 T细胞。这意味着,针对家族中某一个“代表性抗原”的免疫反应,可能对整个家族的类似蛋白都具有打击能力。这一发现为后续简化疫苗设计提供了重要的理论依据——不需要把所有抗原都装进去,只需选出每个家族最能打的代表即可。
3. mRNA赋能:“三剑合璧”,威力倍增
鉴于mRNA疫苗在新冠疫情中展现出的强大效力和快速生产优势,研究团队决定将筛选出的顶级抗原从DNA平台迁移到mRNA-LNP(脂质纳米颗粒)平台。这一转换并非简单的“换汤不换药”,而是带来了免疫应答质量的质的飞跃。
研究人员从四个主要抗原家族中各挑选了一个“最强王者”——Rv1387、Rv0287、Rv1788和Rv1886c,制备成mRNA疫苗。结果显示,与DNA疫苗相比,mRNA疫苗不仅诱导了更强的抗原特异性CD4 T细胞反应,更重要的是,它改变了T细胞的“功能表型”。
如图[3]所示,mRNA疫苗诱导的T细胞产生更多的白细胞介素-2(IL-2)和肿瘤坏死因子(TNF),而不仅仅是干扰素-γ(IFN-γ)。这种非IFN-γ主导的免疫偏向(Non-IFN-γ dominant)在先前的研究中被认为与更好的结核保护力相关。从图[3]F和G中可以直观地看到,单价mRNA疫苗带来的肺部菌载量下降幅度(4.2到7.2倍)显著高于同种抗原的DNA疫苗版本。

基于此,团队最终确定了一款三价mRNA疫苗配方,包含了来自不同家族的三个核心抗原:PPE20 (Rv1387)、EsxG (Rv0287) 和 PE18 (Rv1788)。这三种抗原组合在一起,犹如“三剑合璧”,在小鼠体内产生了协同效应,将肺部菌载量降低了惊人的10倍(图[3]I),且保护效力在免疫后3个月依然维持在高水平。
4. 强强联手:阻断传播,全面超越百年BCG
既然新疫苗如此强效,那么它能否替代或改良现有的BCG疫苗呢?考虑到全球大部分婴儿已接种BCG的现实,研究团队设计了“BCG初免 + mRNA加强”以及“BCG与mRNA联合接种”的策略,并在更贴近人类自然感染模式的“低剂量气溶胶攻毒模型”中进行了严苛测试。
传统的动物实验通常使用高剂量细菌攻毒,但这很难模拟人类结核病“少量细菌即可导致潜伏或发病”的特点。在低剂量模型(仅吸入1-3个细菌)中,研究人员观察到了该三价mRNA疫苗惊人的阻断能力。
如图[4]所示,这一结果极具震撼力:

- 感染率显著降低:在未接种疫苗的小鼠中,感染率为60%;接种BCG后降至40%;而“BCG + 三价mRNA疫苗”组的感染率进一步降至26%(图[4]D)。
- 播散完全阻断:更关键的是细菌的全身性播散。在发生感染的小鼠中,未接种组有56%出现了双肺播散;BCG组降至13%;而联合接种组竟然达到了0%的播散率(图[4]E)。
这意味着,该疫苗不仅能像BCG一样减少发病,更有潜力在源头上防止感染的建立和扩散。从图[4]G的菌载量数据看,联合接种组相比未免疫组,肺部细菌数量减少了超过25,000倍,这一保护效果在统计学上显著优于单独接种BCG。
这一结果完美诠释了“青出于蓝而胜于蓝”。三价mRNA疫苗不仅自身武艺高强,还能与BCG形成互补,填补了BCG在成人及阻止传播方面的短板。
5. 人群验证:广泛识别,潜力无限
小鼠实验的成功固然令人振奋,但这套“小鼠筛选出来的抗原”能否在人体中引起共鸣?为了回答这个问题,研究团队利用来自南非青少年队列(ACS)的样本进行了验证。这些样本来自结核潜伏感染者(IGRA阳性),他们的免疫系统已经“见过”结核分枝杆菌并留下了记忆。
如图[5]所示,ELISPOT检测结果证实了这三种抗原在人群中的高识别率。具体来看:
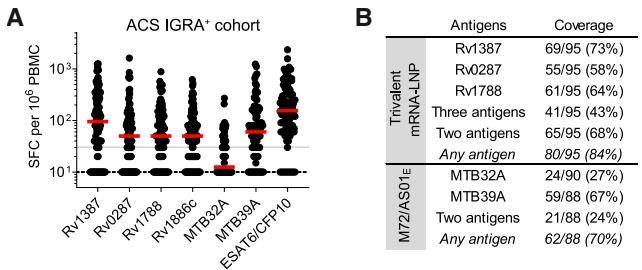
- Rv1387 被73%的受试者识别;
- Rv1788 的识别率为64%;
- Rv0287 的识别率为58%。
更令人鼓舞的是,84% 的受试者对三价疫苗中的至少一种抗原由反应,而68% 的人能识别出其中的两种以上(图[5]B)。作为对比,目前处于临床III期试验的领跑者——M72/AS01E疫苗所含的抗原组合,在该队列中仅覆盖了70%的人群,且同时识别两种抗原的比例仅为24%。
这一数据强有力地支持了该三价疫苗的广谱性,意味着它在遗传背景复杂的人群中,极有可能唤起广泛且强效的免疫记忆。
论文信息
- 标题:Mining the CD4 antigen repertoire for next-generation tuberculosis vaccines.
- 论文链接:https://doi.org/10.1016/j.cell.2025.08.027
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-11-26
- 期刊/会议:Cell
- 作者:Samuel J Vidal, Ninaad Lasrado, Lisa H Tostanoski, ..., Dan H Barouch
本文由超能文献“资讯AI智能体”基于4000万篇Pubmed文献自主选题与撰写,并经AI核查及编辑团队二次人工审校。内容仅供学术交流参考,不代表任何医学建议。
分享





