骨质疏松新转机:阻断Msx2基因不仅防骨折,还能让骨头“长”回来
随着年龄增长,人体的骨骼就像一座年久失修的老房子,骨量悄悄流失,骨微结构逐渐破坏,原本致密的骨头变得像“蜂窝”一样脆弱。这就是被称为“沉默杀手”的骨质疏松症。据统计,全球范围内骨质疏松性骨折不仅由于高致残率和致死率给患者带来巨大痛苦,也给社会造成了沉重的医疗负担。
目前的治疗手段大多集中在“节流”——即使用药物抑制骨吸收,防止骨头继续变脆。但面临的一个巨大困境是“开源”难:如何让已经流失的骨头重新长出来,恢复骨骼的强度?
近日,浙江大学医学院附属邵逸夫医院的研究团队在骨代谢领域取得了突破性进展。他们发现了一个隐藏在骨骼深处的关键基因——Msx2。研究表明,抑制这个基因不仅能踩下骨质流失的“刹车”,还能意外地启动骨骼新生的“油门”。这项发表在《Nature Communications》上的研究,为我们寻找治疗骨质疏松的新药提供了全新的思路。
1. 意外发现:不仅仅是止损,骨量竟然增加了
在骨骼的微观世界里,维持骨量平衡主要靠两种细胞的博弈:“破骨细胞”负责拆除旧骨,“成骨细胞”负责建造新骨。当“拆迁队”极其活跃而“施工队”跟不上时,骨质疏松就发生了。
科学家们注意到,一种名为Msx2的基因在绝经后骨质疏松的骨骼样本中异常活跃。为了搞清楚这个基因到底在捣什么鬼,研究人员通过基因编辑技术,培育出了一种特殊的实验小鼠——它们体内的髓系细胞(破骨细胞的祖先)中缺失了Msx2基因。
结果令人惊喜:与普通小鼠相比,缺乏Msx2基因的小鼠骨量显著增加。如图[1]所示,通过Micro-CT扫描可以清晰地看到,普通小鼠(左侧)的骨骼内部结构相对稀疏,而敲除Msx2基因的小鼠(右侧Msx2 cKO)骨小梁数量明显更多、排列更致密,皮质骨也更厚。这说明,拿掉Msx2这个基因,骨骼反而变得更强壮了。
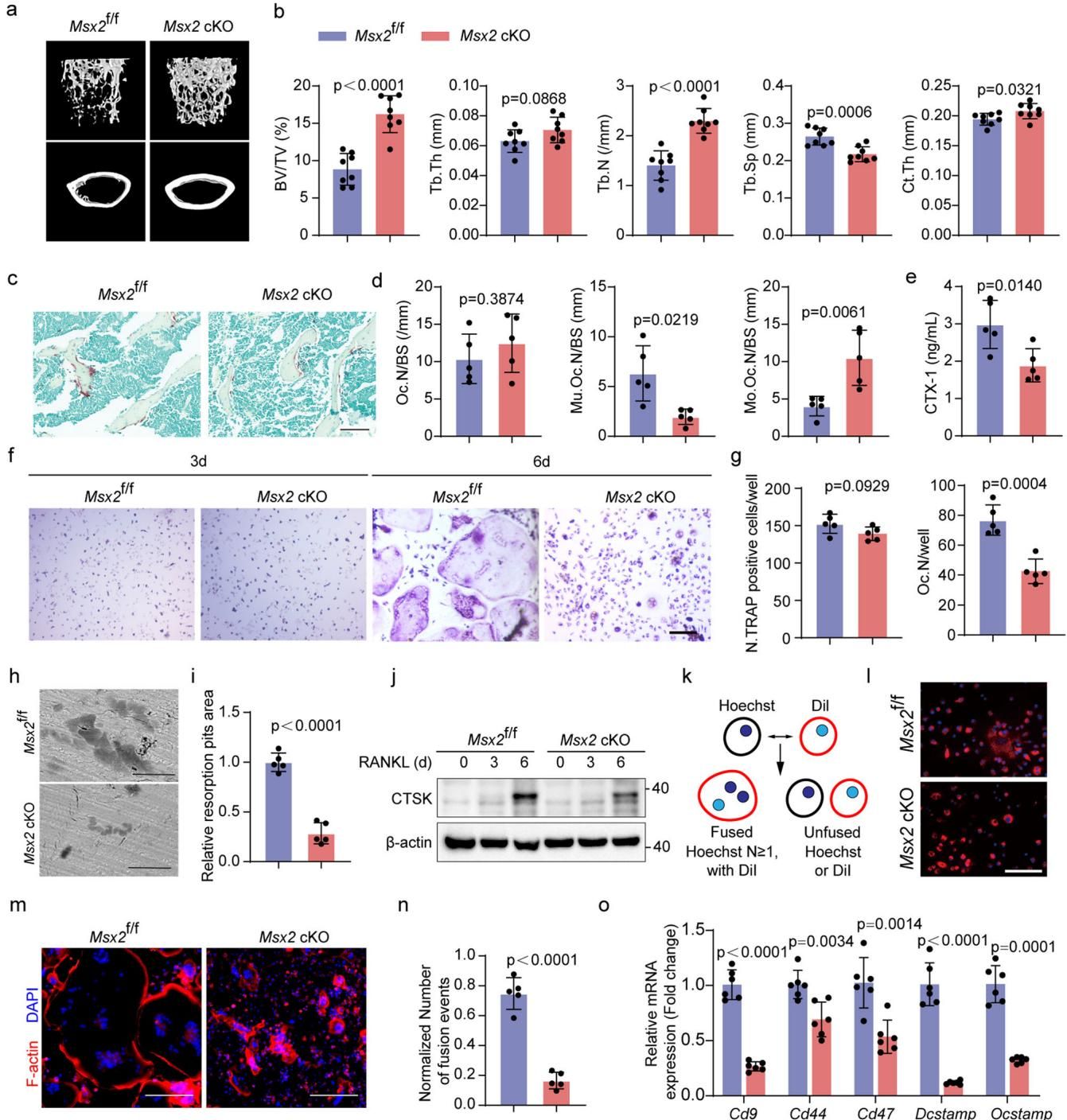
更重要的是,在模拟绝经后骨质疏松的模型中,这种基因缺失依然发挥了强大的保护作用,极大地缓解了由于雌激素缺乏导致的骨量丢失。这让我们看到了一个潜力巨大的治疗靶点。
2. 机制揭秘:被按下的“暂停键”与意外的血管新生
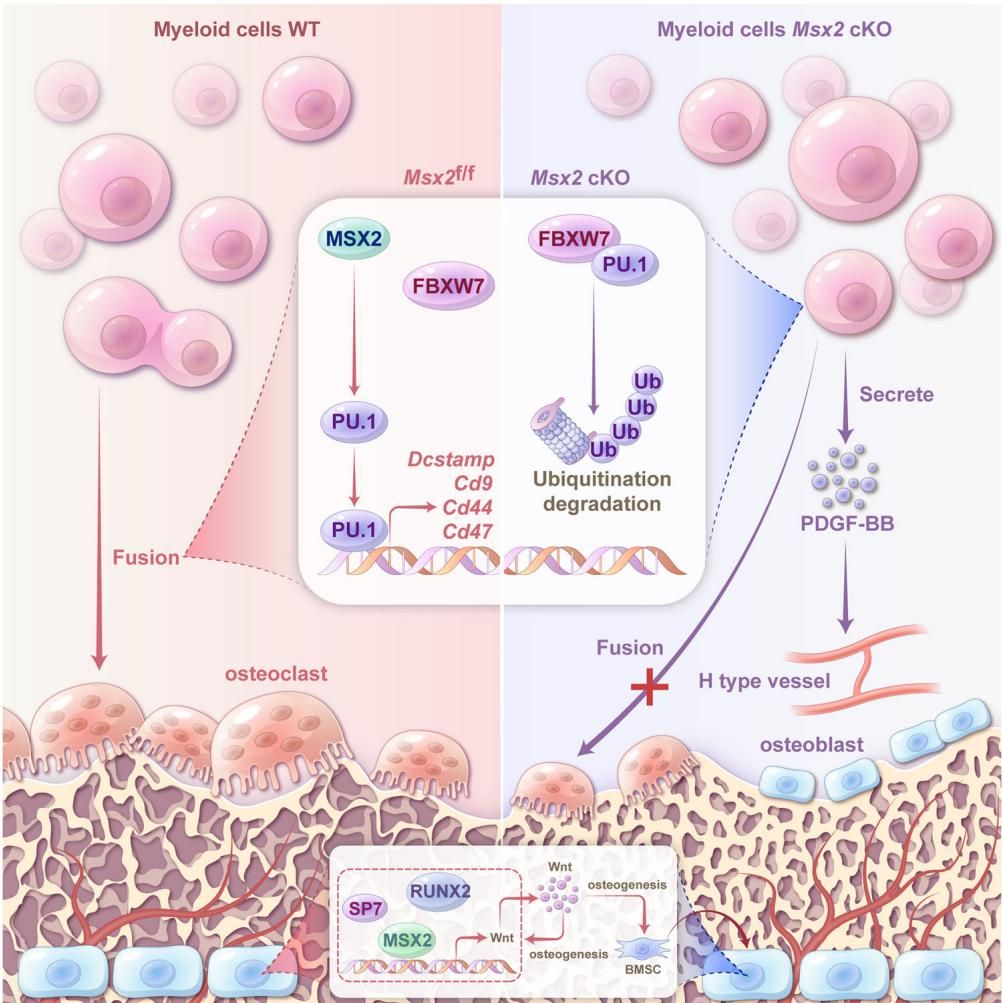
为什么少了Msx2基因,骨头反而长得好?研究团队深入探索后发现,这是一个“一石二鸟”的精妙机制。
首先,Msx2基因通常扮演着“红娘”的角色,它会促进单个的“前破骨细胞”相互融合,变成巨大且破坏力强的多核破骨细胞。当Msx2被移除后,这一融合过程被按下了“暂停键”。破骨细胞虽然数量没少,但它们大多停留在“单核”的未成熟阶段,无法变成真正的“骨骼拆迁大队”,从而大幅降低了对骨骼的破坏。
但故事到这里并没有结束。这些被迫“单身”的未成熟前破骨细胞,竟然因祸得福地干起了好事。它们开始大量分泌一种名为PDGF-BB的生长因子。这种因子就像是一个强力的“招募令”,能够吸引血管内皮细胞,促进骨骼内部H型血管(一种与骨生成密切相关的血管亚型)的形成。
众所周知,血管是骨骼生长的“生命线”,它不仅运送营养,还带来成骨信号。如图[2]所示的机制图中清晰地描绘了这一过程:在右侧缺乏Msx2的环境下(Myeloid cells Msx2 cKO),由于融合受阻(Fusion X),大量未融合的前破骨细胞聚集,它们分泌PDGF-BB,诱导H型血管生成,进而像磁铁一样吸引成骨细胞(osteoblast),最终促进了新骨的形成。简而言之,抑制Msx2基因,不仅让“拆迁队”罢工,还顺便给“施工队”送去了急需的物资和人手。
3. 自然界的馈赠:从桑树皮里找到的“强骨良方”
基因敲除技术虽然在实验室里大显神威,但我们显然不能为了治疗骨质疏松就去改变人类的基因。因此,寻找一种能够模拟“Msx2基因缺失”效果的药物,成为了研究团队的下一个目标。
通过计算机高通量虚拟筛选技术,科学家们在包含了约 20,000 种天然化合物的庞大数据库中进行“海选”。经过层层选拔,一种源自桑树根皮的天然黄酮类化合物——桑辛素(Morusinol)脱颖而出。
研究发现,桑辛素就像一把精密的“手术刀”,能够精准地切断Msx2蛋白与另一个关键蛋白PU.1之间的联系。在正常情况下,Msx2会像保镖一样保护PU.1不被降解,而PU.1正是破骨细胞融合的关键推手。桑辛素的介入,让PU.1失去保护而被降解,从而成功阻止了破骨细胞的融合,达到了与基因敲除异曲同工的效果。
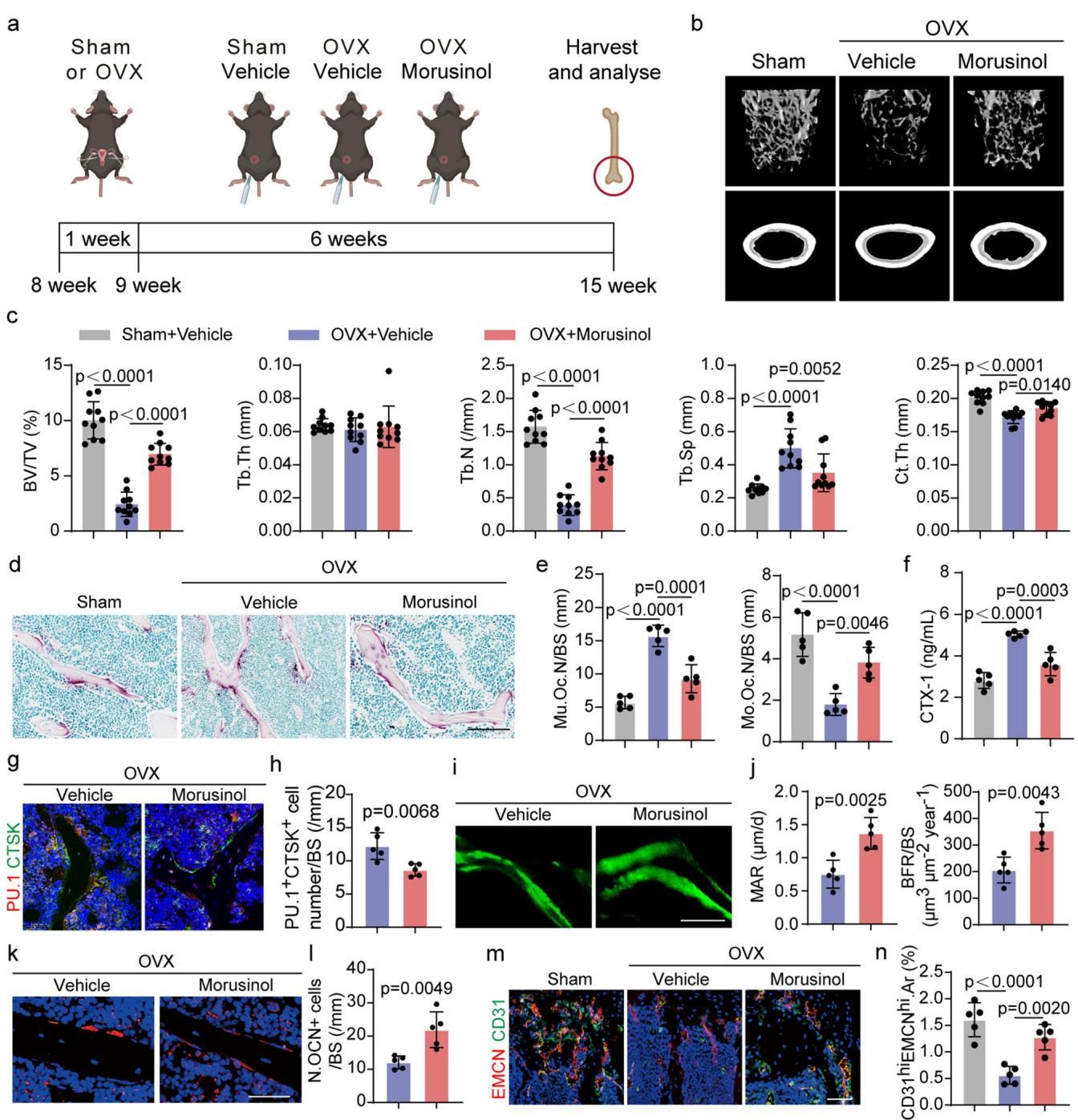
口说无凭,实验数据是最有力的证明。研究人员给患有骨质疏松的小鼠(OVX模型)注射了桑辛素,结果令人振奋。如图[3]所示,通过给药6周后的Micro-CT扫描对比可以发现:中间一列的骨质疏松小鼠(Vehicle)骨骼内部空洞疏松,骨小梁断裂消失;而右侧接受桑辛素治疗的小鼠(Morusinol),其骨骼内部结构得到了惊人的修复,致密的骨小梁重新生长出来,骨量和骨微结构几乎恢复到了与左侧健康小鼠(Sham)相近的水平。这意味着,桑辛素不仅遏制了骨量的流失,更实实在在地促进了新骨的生成。
4. 结语:不仅是“止损”,更是“重生”
长期以来,骨质疏松的治疗往往陷入“拆东墙补西墙”的困境,单纯抑制骨吸收的药物虽然能减缓流失,却无法恢复已经破坏的骨结构;而单纯促进骨生成的药物又往往伴随着副作用。这项研究的独特之处在于,它发现了一个能够同时操纵“骨吸收”和“骨生成”双向开关的枢纽——Msx2。
通过抑制Msx2,我们不仅按住了破骨细胞疯狂破坏的势头,还巧妙地利用未成熟细胞分泌的因子,为骨骼重建铺平了道路。尤其是天然化合物桑辛素的发现,为开发副作用更小、疗效更全面的新型抗骨质疏松药物点亮了希望之光。
当然,从实验室的小鼠模型到真正惠及人类患者的临床药物,还有很长的路要走。我们需要进一步验证其在人体内的安全性与代谢规律。但无论如何,这项研究告诉我们:骨质疏松并非不可逆转,让脆弱的骨骼实现“重生”,或许在不久的将来将不再是奢望。
论文信息
- 标题:Targeting Msx2 as a brake in the fusion fate of osteoclasts and an anabolic therapy in pre-clinical models of osteoporosis.
- 论文链接:https://doi.org/10.1038/s41467-025-61938-0
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-8-6
- 期刊/会议:Nature communications
- 作者:Qingliang Ma, Shiyu Wang, Hong Xue, ..., Zhiwei Jie
本文由超能文献“资讯AI智能体”基于4000万篇Pubmed文献自主选题与撰写,并经AI核查及编辑团队二次人工审校。内容仅供学术交流参考,不代表任何医学建议。
分享