
肿瘤学家最头疼的问题之一,不是癌细胞有多凶猛,而是它们有多"狡猾"。当医生精心设计的靶向药物杀向肿瘤时,一些癌细胞竟然能临时"换装"——从肺癌细胞变得像皮肤细胞,从胰腺癌细胞长出鳞状上皮的模样。这种变身不是科幻,而是肿瘤可塑性的真实写照。治疗失败,往往不是药物不够强,而是癌细胞改换身份后,药物根本认不出它们了。
2025年11月,冷泉港实验室Christopher Vakoc教授团队在《自然·通讯》(Nature Communications)和《细胞报告》(Cell Reports)接连发表两项研究[1][2],揭开了这场"变形记"背后的分子开关。他们发现,一个名为KLF5的蛋白质决定着胰腺癌细胞是保持经典形态还是转变为鳞状细胞样;而在致命的簇细胞型肺癌中,POU2F3蛋白的晶体结构首次被解析,为阻断这类癌症的身份维持机制提供了精确的靶点图谱。
当癌细胞学会"七十二变"
"这些肿瘤在细胞身份上极具可塑性,"Vakoc在实验室里说,"有些甚至会改变身份来躲避为消灭它们而设计的疗法。"[3]
这不是夸张。以胰腺导管腺癌(PDAC)为例,这是最致命的癌症之一,五年生存率仅约12%。近年来研究发现,胰腺癌可以分为"经典型"和"基底样型"(也称鳞状型)两大亚型。经典型相对温和,对化疗敏感;基底样型则更具侵袭性,对治疗高度耐药,患者预后极差。更麻烦的是,同一个患者的肿瘤内部,两种亚型的细胞可能共存,甚至在治疗压力下相互转换[1]。

这种现象在小细胞肺癌(SCLC)中更加极端。2018年,Vakoc团队发现了一种新的肺癌亚型——簇细胞型小细胞肺癌(SCLC-P)[4]。这类癌细胞不表达神经内分泌标记物,却表达正常肠道和呼吸道中簇细胞的特征基因。簇细胞原本是味觉感受细胞,数量稀少,但在这类肺癌中,癌细胞劫持了簇细胞的身份程序,形成了一种治疗反应极差的特殊亚型。
问题来了:癌细胞的"变脸"受谁控制?如果能找到那个主控开关,是否就能锁死它们的身份,让药物重新起效?
KLF5:胰腺癌的"双面间谍"
Vakoc团队在胰腺癌细胞系中进行了大规模CRISPR筛选,寻找维持不同细胞亚型身份的关键基因。结果指向了一个名为KLF5的转录因子。
KLF5(Krüppel-like factor 5)本是一个调控细胞增殖和分化的"老熟人",在多种上皮组织中发挥作用。但Vakoc团队发现,它在胰腺癌中扮演着矛盾的双重角色:在经典型胰腺癌细胞中,KLF5维持着经典的腺体形态和基因表达程序;而在基底样型癌细胞中,同一个KLF5却驱动着鳞状分化,激活角蛋白、上皮钙黏蛋白等鳞状标志基因[1]。
这怎么可能?一个蛋白质怎么能在两种细胞中做相反的事?
答案在于KLF5的"帮凶"。研究发现,KLF5并不是独立作战,它需要招募共激活因子来发挥功能。在两种亚型的胰腺癌细胞中,KLF5结合的共激活因子不同——这就像同一把钥匙,插入不同的锁孔,开启了不同的门。

具体来说,KLF5通过与RUVBL1和RUVBL2两个AAA+ ATP酶互作来完成这一任务。这两个分子像是"分子马达",能够重塑染色质结构,让特定基因变得可读或不可读。在经典型细胞中,KLF5-RUVBL复合体打开的是一套基因;在基底样型细胞中,打开的是另一套。ChIP-seq数据显示,KLF5在两类细胞中都结合了约2025个共享的调控元件,但招募的下游转录机器截然不同[1]。
研究者用小分子抑制剂阻断KLF5-RUVBL互作后,胰腺癌细胞的生长明显受到抑制,而且在小鼠模型中未观察到明显毒性。这提示,靶向KLF5或其共激活因子,可能成为同时打击胰腺癌两种亚型的新策略。
POU2F3:簇细胞癌的"身份证"
如果说KLF5是胰腺癌的"双面间谍",那么POU2F3就是簇细胞型肺癌的"唯一身份证"。
POU2F3是一个POU家族转录因子,正常情况下只在簇细胞中高表达,负责维持这种稀有细胞的独特身份。2018年Vakoc团队发现,约15%的小细胞肺癌高表达POU2F3,这些肿瘤完全依赖POU2F3维持生存——敲除POU2F3,癌细胞立即死亡[4]。这是一个完美的治疗靶点,但问题是,如何靶向一个转录因子?
转录因子通常被认为是"不可成药"的靶点,因为它们没有明显的催化活性位点,主要通过蛋白质-蛋白质和蛋白质-DNA相互作用发挥功能。要开发针对转录因子的药物,首先需要知道它如何工作。

在最新的《细胞报告》研究中,Vakoc团队与冷泉港实验室研究主任Leemor Joshua-Tor合作,首次解析了POU2F3与共激活蛋白OCA-T1以及DNA形成的三元复合物的晶体结构[2]。
这个结构美得让人屏息。电子显微镜下,POU2F3的POU结构域像一对钳子夹住DNA双螺旋,而OCA-T1则紧密贴合在POU2F3的背侧,形成一个稳定的"三明治"结构。研究者还通过深度突变扫描(deep mutational scanning)技术,系统测试了数百个氨基酸突变对复合物稳定性的影响,精确描绘出了相互作用的关键界面[2]。
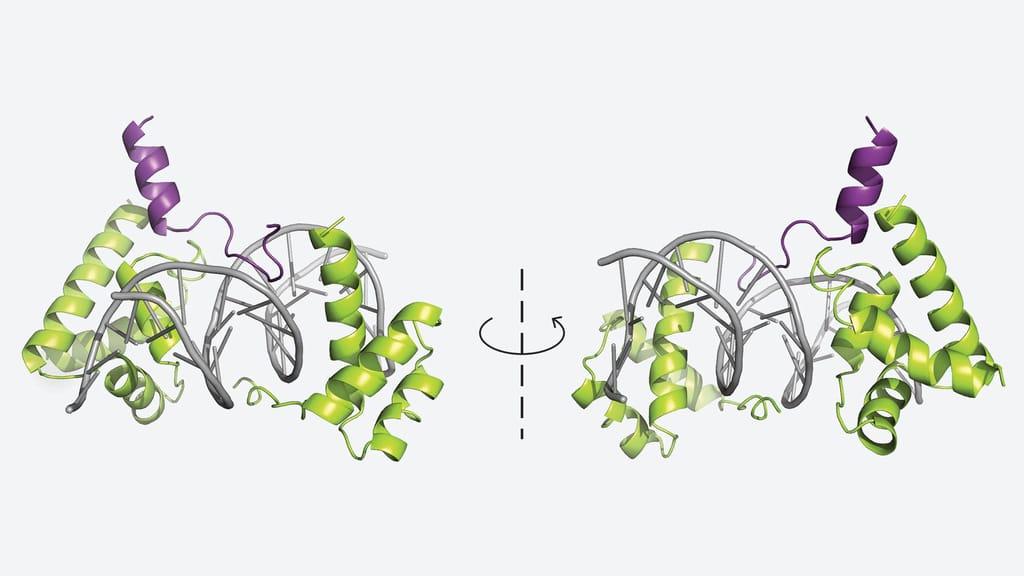
这个结构对于药物开发至关重要。它告诉药物化学家,小分子应该攻击哪个界面,才能破坏POU2F3与OCA-T1的结合,从而阻断簇细胞癌的身份维持。虽然从结构到药物还有很长的路,但至少,设计的方向已经明确。
"这是一个完整的闭环时刻,"Vakoc说。2018年发现新的肺癌亚型时,他们聚焦的是表观遗传调控——关注基因如何被读取,而不是基因本身。现在,结构生物学的突破让他们看到了开发表观遗传疗法的可能,这种疗法专门针对癌细胞的转录程序,而不伤及正常细胞[3]。
"我们设定了更高的标准"
Vakoc过去17年的核心目标一直是:找到决定细胞身份的主控调控因子。
这听起来有点像寻找癌症的"阿喀琉斯之踵"。如果每种癌症都有一个或几个主控因子决定其身份,那么靶向这些因子,理论上就能摧毁肿瘤,而不伤害正常组织。这个思路并非天方夜谭——乳腺癌的雌激素受体疗法、前列腺癌的雄激素阻断疗法,本质上都是在靶向细胞身份的维持机制。
但要让这个思路在其他癌症中奏效,关键在于特异性。Vakoc团队在两项研究中都强调,他们在小鼠模型中测试时,无论是靶向胰腺癌的KLF5通路,还是靶向肺癌的POU2F3通路,都没有观察到对主要器官的毒性迹象[1][2]。
"我们在新的癌症靶点和治疗方面,设定了更高的特异性标准,"Vakoc说[3]。这句话意味深长。过去的化疗药物,杀敌一千自损八百;即使是靶向药物,也常因脱靶效应导致严重副作用。而针对细胞身份主控因子的疗法,如果设计得当,理论上可以做到"只杀癌细胞,不伤正常细胞"。
当然,从小鼠到人类,从实验室到临床,中间还隔着无数道鸿沟。KLF5和POU2F3的抑制剂都还在早期研发阶段,距离患者用药可能还要十年。但至少,方向是对的。
可塑性:癌症的诅咒与机会
肿瘤可塑性一直被视为癌症治疗的"诅咒"——正是因为癌细胞能改变身份,单一靶向疗法才总是失败。但Vakoc团队的工作提示,可塑性也可能是一个机会。
如果我们能理解可塑性的分子机制,就能预测癌细胞在治疗压力下会"逃"向哪个方向。比如,在胰腺癌中,如果能同时靶向经典型和基底样型的维持机制,就能堵死癌细胞的"变身"通道。再比如,在簇细胞型肺癌中,如果能阻断POU2F3的功能,这类癌细胞可能既无法维持原有身份,也无法转化为其他亚型,最终只能死亡。
更进一步,理解细胞身份的调控机制,有助于建立新的癌症分类体系。传统上,癌症按组织器官分类——肺癌、胃癌、肝癌。但随着分子生物学的进步,越来越多证据表明,癌症应该按细胞身份分类——簇细胞型癌、鳞状细胞型癌、神经内分泌型癌等。不同身份的癌症,即使长在同一个器官,治疗策略也应该完全不同。
Vakoc团队的研究,正是朝这个方向迈出的重要一步。他们不仅在发现新的癌症亚型,更在试图理解每种亚型背后的身份维持逻辑。这种理解,最终将转化为更精准、更有效的治疗方案。
从基因到疗法,还要走多远?
科学论文的结尾总是谨慎而乐观的。Vakoc说,从这些发现到新药物的诞生,"还有很长的路要走"[3]。但他同时强调,他们的工作不仅是为了开发新药,更是为了"建立对细胞身份更深层次的理解",而这种理解将"帮助塑造一个新的、更好的护理标准"[3]。
这话听起来有点虚,但仔细想想,确实如此。医学进步从来不是靠一个药物、一个疗法的突破,而是靠整个知识体系的更新。当我们真正理解了癌细胞如何获得、维持和改变其身份,当我们能够精准描绘每个患者肿瘤的身份图谱,当我们能够设计出既杀伤肿瘤又不伤及正常组织的疗法——那时,癌症治疗才算真正进入了"精准医学"的时代。
而这个时代的到来,需要像Vakoc团队这样的基础研究者,一个蛋白、一个结构、一篇论文地推进。需要将结构生物学、表观遗传学、癌症生物学、药物化学融合在一起的交叉学科努力。需要从实验室到临床的漫长转化过程,以及无数次失败后的坚持。
至少现在,我们知道了癌细胞"变脸"的一部分秘密。知道了KLF5如何让胰腺癌在两副面孔间切换,知道了POU2F3如何给簇细胞癌颁发"身份证"。这些知识,终将汇聚成击败癌症的力量。
或许十年后,当医生拿到一份胰腺癌病理报告时,不会再简单地说"这是晚期胰腺癌,没什么好办法"。他会说:"这是KLF5高表达的基底样型胰腺癌,我们有专门的抑制剂。"或者:"这是簇细胞型肺癌,POU2F3抑制剂刚刚上市,效果不错。"
那时,癌细胞的"变形记",将不再是治疗失败的注脚,而是被我们理解、预测和克服的医学历史。
参考文献:
[1] Cunniff, P.J., et al. KLF5 drives dichotomous lineage programs in pancreatic cancer via AAA+ ATPase coactivators. Nature Communications, 2025年11月15日. DOI: 10.1038/s41467-025-66007-0. https://www.nature.com/articles/s41467-025-66007-0
[2] Alpsoy, A., et al. Structural Basis of DNA-Dependent Coactivator Recruitment by the Tuft Cell Master Regulator POU2F3. Cell Reports, 2025年11月18日. DOI: 10.1016/j.celrep.2025.116572. https://www.cell.com/cell-reports/fulltext/S2211-1247(25)01344-0
[3] Cold Spring Harbor Laboratory. Shapeshifting cancers' masters, unmasked. 2025年11月24日. https://www.cshl.edu/shapeshifting-cancers-masters-unmasked/
[4] Huang, Y.H., et al. POU2F3 is a master regulator of a tuft cell-like variant of small cell lung cancer. Genes & Development, 2018年6月26日. DOI: 10.1101/gad.314815.118
作者:超能文献团队 | 超能文献
分享
推荐阅读

人类能活到150岁吗?Nature揭示抗衰老研究最新突破
Nature最新专题报道揭示两位顶级科学家关于人类能否活到150岁的争论,IL-11抑制剂在小鼠实验中延长寿命25%,谷歌子公司Calico投资近6亿美元开发抗衰老药物,多种疗法正在临床试验。

一针永久降血脂?CRISPR基因编辑首次人体试验:胆固醇骤降50%,NEJM重磅发布
克利夫兰诊所领导的全球首个CRISPR降脂人体试验显示,一次注射即可永久关闭ANGPTL3基因,胆固醇和甘油三酯双双暴降

CRISPR"隐形"细胞:糖尿病患者6个月不打胰岛素
2024年12月,一名1型糖尿病患者接受了经过CRISPR编辑的供体胰岛细胞移植。六个月后,这些细胞依然在他手臂肌肉里稳定工作,无需任何免疫抑制药物。这是细胞治疗领域的分水岭时刻。

超加工食品的全球警报:《柳叶刀》揭示人类健康的隐形杀手
覆盖104项研究的综合分析显示,92%的研究证实超加工食品与慢性病相关。这场由跨国食品公司主导的饮食革命,正在成为21世纪最严重的公共卫生威胁之一。
