
别把脂肪只当“储油罐”:STTT顶刊揭示B2M蛋白如何操控细胞“自爆”并引燃全身炎症
在当今世界,肥胖已然成为一场席卷全球的健康危机。根据世界肥胖联盟的预测,超重和肥胖正在成为2型糖尿病、脂肪肝、心血管疾病甚至癌症等一系列慢病的“万恶之源”。
我们常说“一胖毁所有”,但在微观层面,毁掉健康的不仅仅是沉重的体重,更是一场在体内悄无声息蔓延的“慢性低度炎症”。长久以来,科学界的一个共识是:肥胖的脂肪组织不仅是能量仓库,更是一个巨大的“炎症工厂”。这种持续的炎症风暴会随着血液循环波及肝脏、肌肉甚至大脑,最终导致胰岛素抵抗和全身性代谢崩盘。
但这场“火”究竟是谁最先点燃的?
教科书式的答案通常指向免疫细胞,特别是脂肪组织巨噬细胞(ATMs)。人们认为,是这些外来的“卫兵”闻讯赶来,包围了脂肪细胞,释放了炎性因子。然而,一个被忽视的关键问题是:如果脂肪细胞只是无辜的受害者,为什么免疫细胞会精准地锁定它们并发起攻击?
近期,陆军军医大学(第三军医大学)吴玉章教授团队在顶级期刊 《Signal Transduction and Targeted Therapy》(STTT) 上发表的一项重磅研究,颠覆了我们对脂肪细胞的传统认知。这项研究揭示了一个惊人的事实:肥大的脂肪细胞并非被动挨打,而是这场炎症风暴的“幕后黑手”。 它们通过过量表达一种名为 β2-微球蛋白(B2M) 的关键分子,一手策划了针对自己的免疫围攻。
这项研究不仅解开了肥胖引发慢性炎症的关键谜题,更为治疗代谢性疾病提供了全新的靶点。今天,我们就来深入剖析这一发现背后的科学逻辑。
1. 谁在通风报信?脂肪细胞的“跨界”伪装
在这个故事中,B2M(β2-Microglobulin) 是绝对的主角。它并不是一个新发现的蛋白,作为主要组织相容性复合体 I 类(MHC-I)分子的轻链,它存在于几乎所有有核细胞表面,负责辅助 MHC-I 分子向 T 细胞呈递抗原——简单来说,就是细胞用来向免疫系统“自证清白”或“发出警报”的身份证。
然而,研究人员通过对比瘦小鼠和肥胖小鼠的脂肪组织转录组发现了一个反常现象:在肥胖小鼠的肥大脂肪细胞中,B2M 基因的表达量出现了异常飙升。
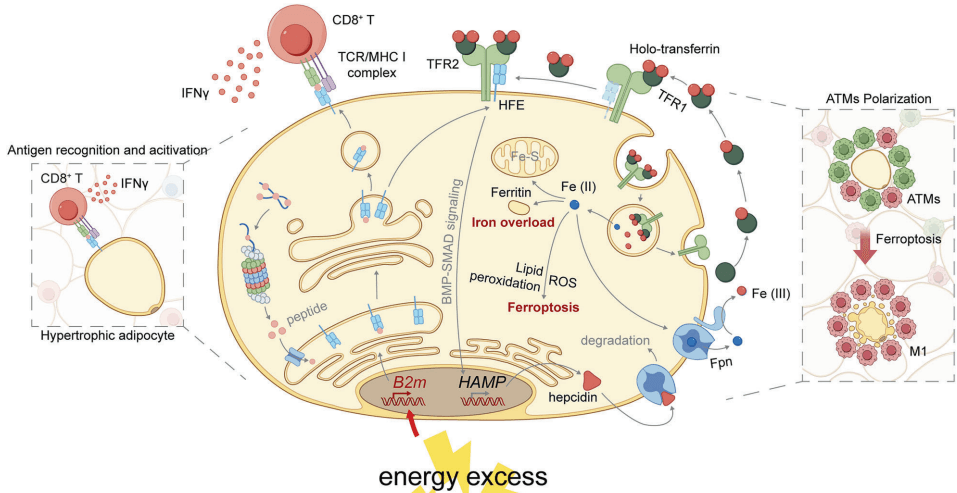
如图[1]所示,研究团队在分析差异表达基因(DEGs)的相互作用网络时发现,免疫相关通路高度富集,而 B2M 恰好处于“抗原加工与呈递”通路和“铁摄取与转运”通路的交叉核心位置。这意味着,在营养过剩的压力下,脂肪细胞内部正在发生一场由 B2M 主导的剧烈重构。
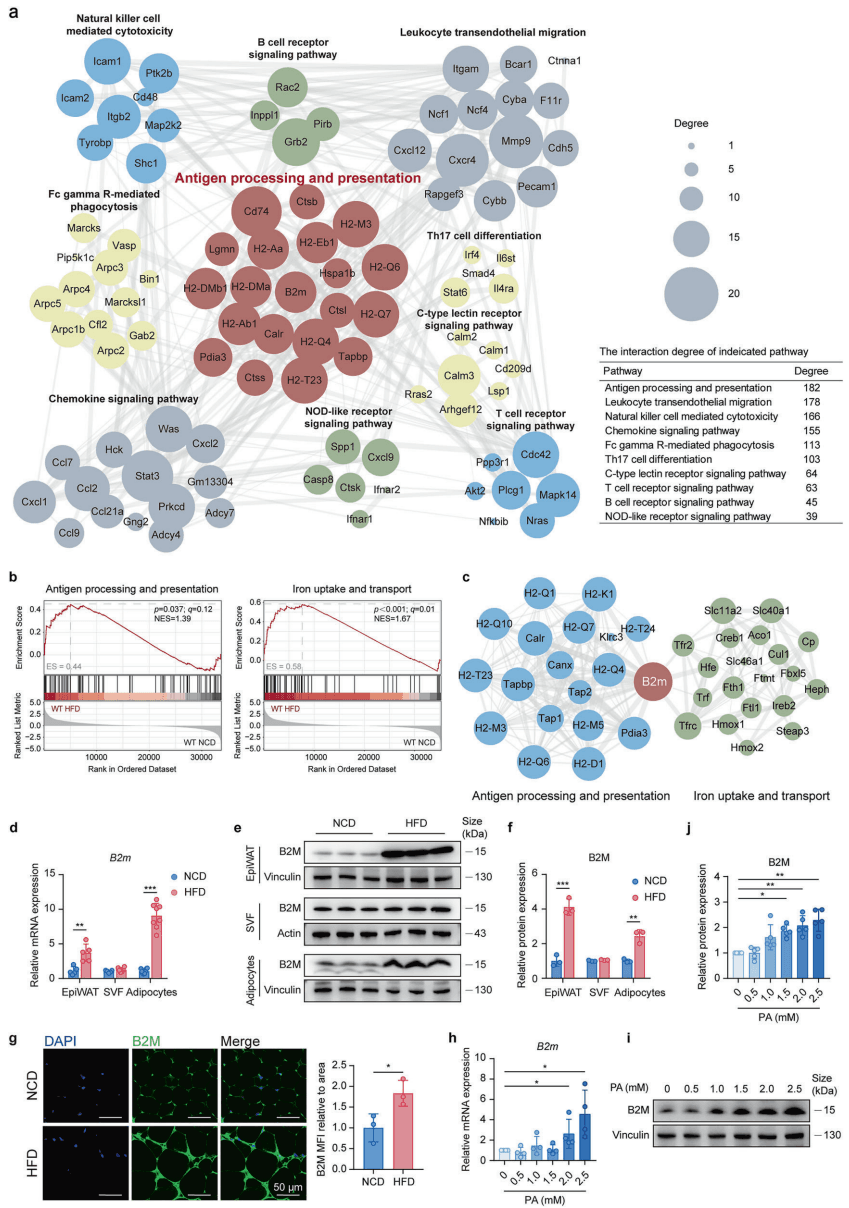
为什么脂肪细胞要大量制造 B2M?
这就涉及到了脂肪细胞的第一重“罪状”:它试图伪装成专业的抗原呈递细胞(APC)。
通常情况下,激活 CD8+ T细胞(细胞毒性T细胞,也就是免疫系统的“杀手”)是专业免疫细胞的工作。但在肥胖状态下,高水平的 B2M 促进了 MHC-I 分子在脂肪细胞表面的大量集结。这就好比一个普通的仓库管理员(脂肪细胞)突然穿上了警服,开始在大街上疯狂招手(抗原呈递)。
研究人员通过精巧的共培养实验证实了这一点。如图[2]所示,当他们将肥大的脂肪细胞与 CD8+ T 细胞放在一起培养时(特别关注图中的示意图 h),只有当两者直接接触且脂肪细胞表达 B2M 时,T 细胞才会被激活并以此增殖。如果隔着一层膜(Transwell小室)或者敲除了脂肪细胞里的 B2M 基因,这种激活就会消失。
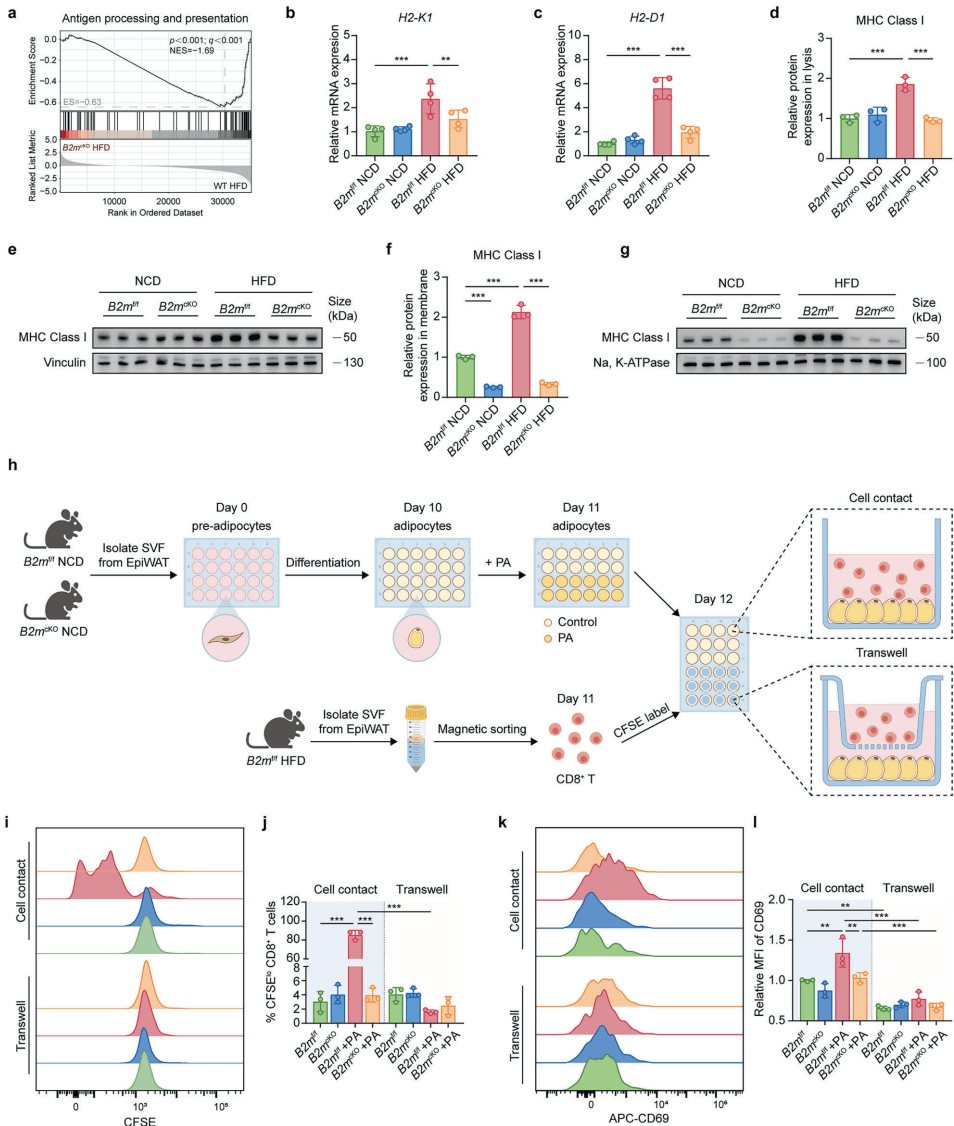
这说明,肥大的脂肪细胞通过 B2M-MHC-I 复合物,通过直接的“肢体接触”,亲手激活了潜伏在脂肪组织里的杀手 T 细胞。 这些被激活的 T 细胞随后会释放干扰素-γ(IFN-γ)等因子,吹响了局部炎症的第一声号角。
2. 致命的囤积:B2M引发的“铁死亡”陷阱
如果说伪装成“免疫哨兵”是脂肪细胞的主动挑衅,那么 B2M 带来的第二个后果则更像是一场失控的“自毁程序”。
在免疫功能之外,B2M 还有一个鲜为人知的身份——铁代谢的“守门人”。它需要与遗传性血色病蛋白(HFE)形成二聚体,才能稳定地存在于细胞膜上,进而调控细胞对铁元素的摄取和排出。
研究团队发现,在肥胖状态下,脂肪细胞内过量的 B2M 彻底打乱了铁代谢的平衡。这就好比一个繁忙的物流中心,原本应该有序进出的货物(铁离子),因为管理系统的混乱,变成了一场灾难。
这个致命的机制是如何运转的?
正常情况下,HFE 主要与转铁蛋白受体 1(TFR1)结合。但在肥胖引发的“营养过剩”压力下,高水平的 B2M 促使 HFE 移情别恋,转而与 转铁蛋白受体 2(TFR2) 紧密结合。这种异常的结合触发了一连串连锁反应:
- 铁调素(Hepcidin)飙升:HFE-TFR2 复合物就像一个错误的开关,刺激细胞疯狂合成铁调素。
- 出口被封死:铁调素是一种铁抑制激素,它会直接降解细胞膜上的“铁泵”——膜铁转运蛋白(FPN)。
- 只进不出:结果就是,铁离子能进入脂肪细胞,却再也出不去了。
如图[3]所示,在肥胖小鼠的脂肪细胞中,我们清晰地看到了这一连串变化:HFE 和 TFR2 的相互作用增强,铁调素水平升高,而负责排铁的 FPN 显著减少。这直接导致了细胞内铁含量的异常累积。
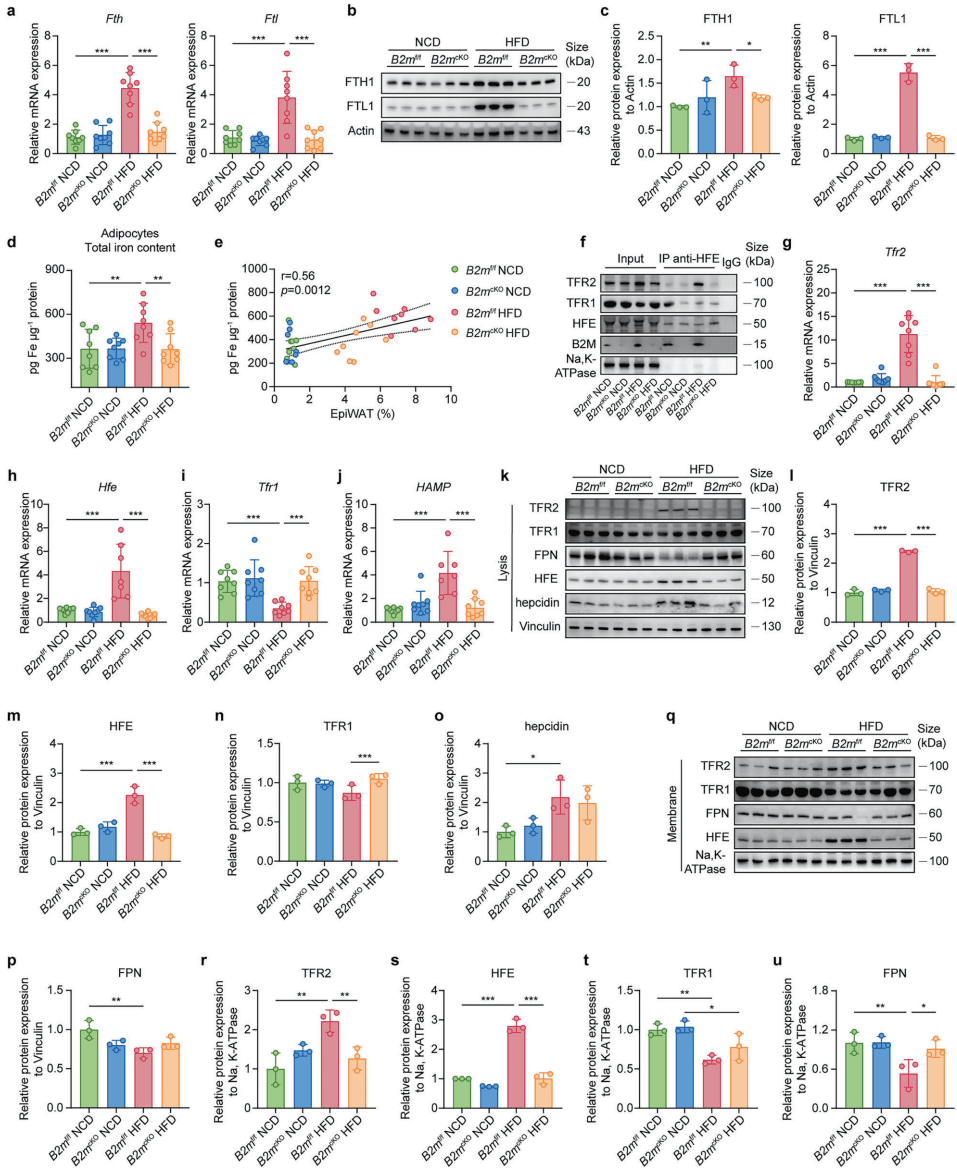
铁是生命必需元素,但过量的铁却是致命的毒药。细胞内囤积的铁会引发著名的“芬顿反应”,产生大量的高活性自由基(ROS),导致脂质过氧化。对于富含脂质的脂肪细胞来说,这无异于在油库里玩火。
这场大火的结局就是——铁死亡(Ferroptosis)。
这是一种铁依赖性的细胞程序性死亡。如图[4]所示,肥大的脂肪细胞中充满了脂质过氧化物(4-HNE)和活性氧(ROS),线粒体萎缩受损,这些都是铁死亡的典型特征。而一旦 B2M 被敲除,这些恐怖的景象便随之消失,脂肪细胞重新恢复了生机。
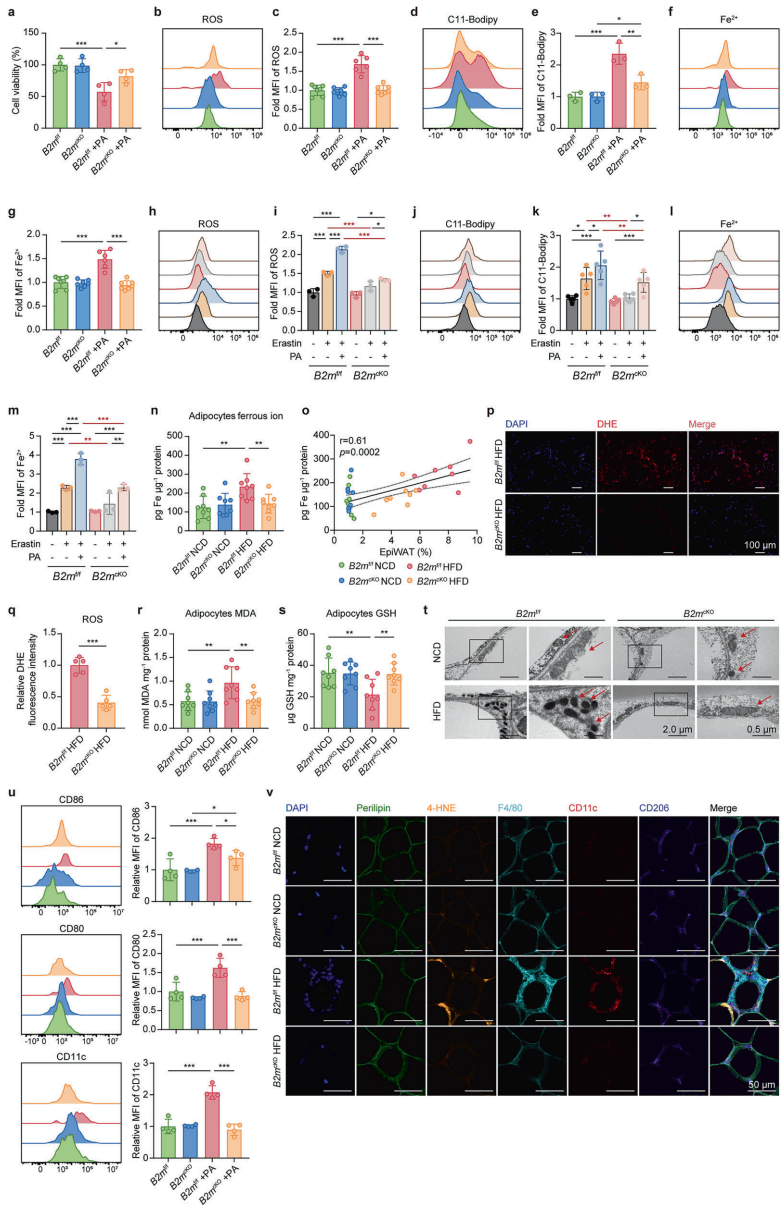
更糟糕的是,死去的脂肪细胞并不会安静地消失。它们释放出的危险信号(DAMPs)像血腥味吸引鲨鱼一样,招募了大量的巨噬细胞。如图[4]中的免疫荧光染色所示,在肥胖小鼠的脂肪组织中,我们可以看到“皇冠状结构”(Crown-like structures, CLS)——这是一群促炎的 M1 型巨噬细胞像皇冠一样围成一圈,正在吞噬濒死或已死的脂肪细胞。而正是这些巨噬细胞,释放了大量的炎症因子,将局部的细胞死亡升级为全身性的慢性炎症。
至此,B2M 的双重致病机制已然清晰:
如图[5]总结的那样,在能量过剩的刺激下,肥大的脂肪细胞上调 B2M。这不仅通过抗原呈递直接“惹怒”了 CD8+ T 细胞,还通过扰乱铁代谢诱导自身“铁死亡”,进而招募并激怒了巨噬细胞。这两条路径殊途同归,共同引爆了肥胖相关的慢性炎症。
3. 釜底抽薪:靶向 B2M 的“减肥”奇迹
既然 B2M 是引发这一系列混乱的罪魁祸首,那么,如果我们将它从脂肪细胞中移除,是否就能平息这场炎症风暴,甚至逆转肥胖呢?
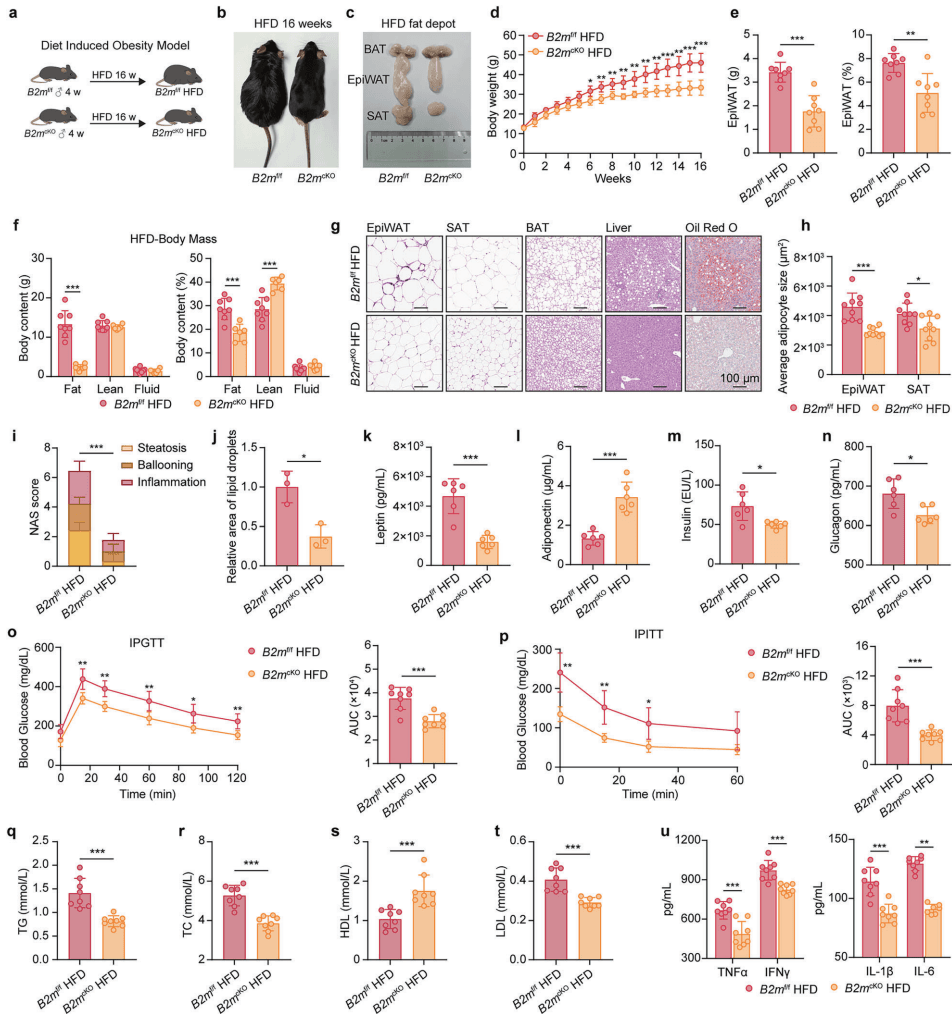
研究团队构建了一种特殊的转基因小鼠,专门敲除了脂肪细胞中的 B2m 基因。结果令人惊喜:在同样摄入高脂饮食(HFD)的情况下,这些“B2M 缺失”小鼠仿佛拥有了“吃不胖”的体质。与普通小鼠相比,它们的体重显著更轻,脂肪组织更少,脂肪细胞的个头也更小。更重要的是,它们没有出现胰岛素抵抗,肝脏也没有被脂肪填满,血液中的炎症因子水平也大幅下降 [6]。
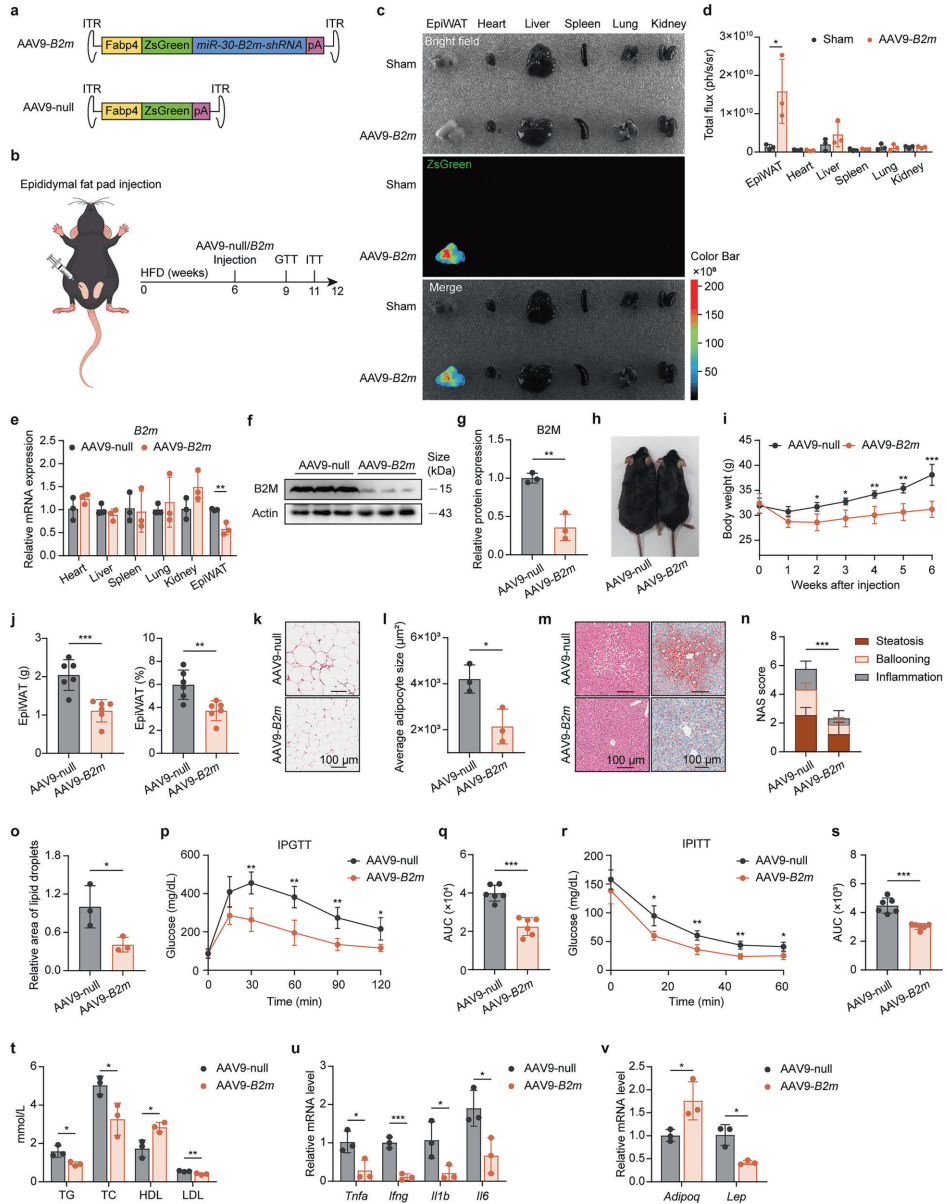
但这还不够。对于那些已经肥胖的人群来说,我们更关心的是“亡羊补牢”是否为时未晚。于是,研究人员使用了一种腺相关病毒(AAV)载体,将其注射到已经肥胖的小鼠脂肪组织中,定点干扰 B2M 的表达。
奇迹再次发生:即使是在肥胖已经形成之后,抑制脂肪组织中的 B2M 依然能够显著减轻体重,改善糖耐量,并消除脂肪肝 [7]。这说明,B2M 不仅是肥胖发生的推手,更是维持肥胖状态及其并发症的关键支柱。抽掉这根柱子,代谢疾病的大厦便会摇摇欲坠。
4. 从实验室到临床:人类数据的强力佐证
小鼠实验的成功固然令人振奋,但这套机制在人类身上是否适用?为了回答这个问题,研究团队深入分析了人类脂肪组织的转录组数据。
结果显示,B2M 与人类肥胖之间存在着惊人的相关性。在肥胖患者,尤其是那些伴有代谢不健康的患者体内,皮下脂肪和内脏脂肪中的 B2M 表达量均显著升高。更具说服力的是,B2M 的表达水平与体重指数(BMI)、胰岛素抵抗指数(HOMA-IR)以及甘油三酯水平呈现出显著的正相关关系,而与保护性的脂联素水平呈负相关 [8]。
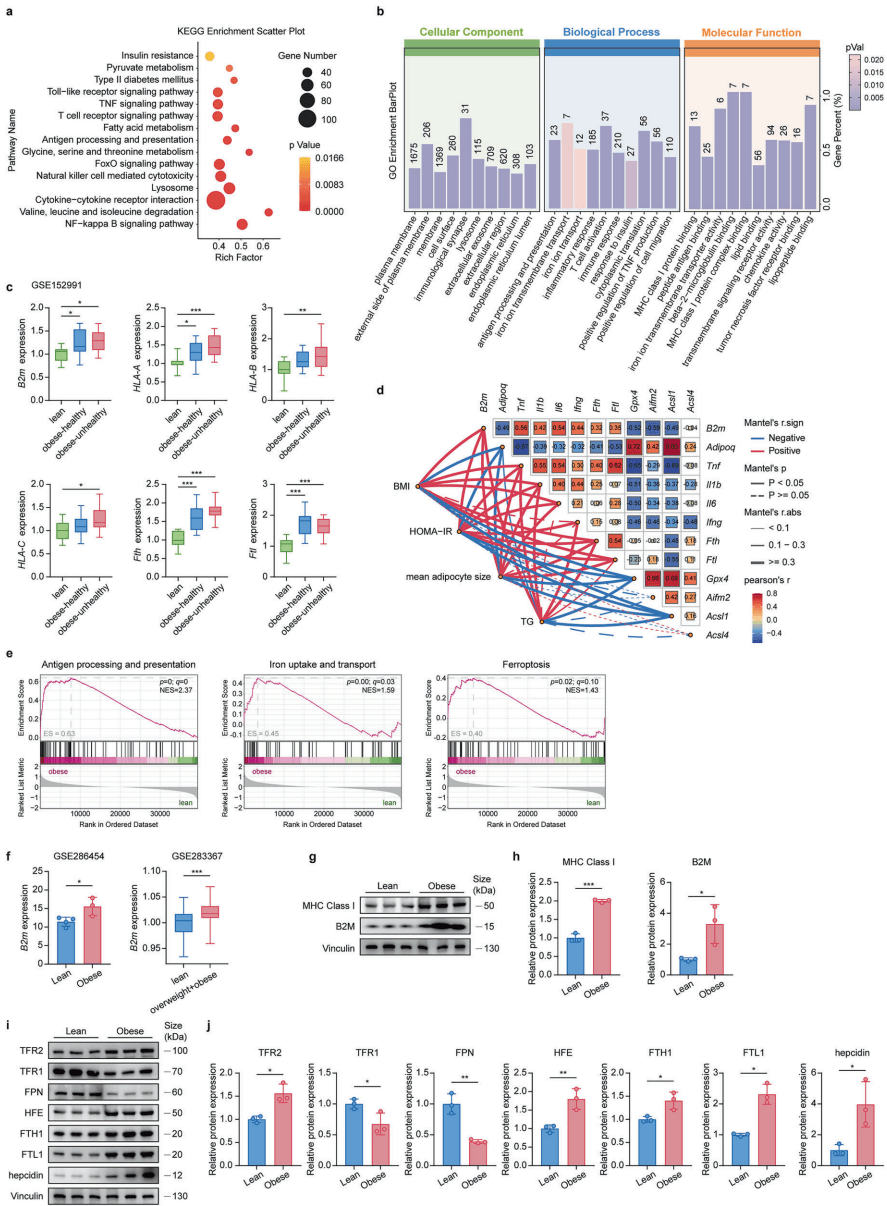
这一发现为研究成果的临床转化补上了最重要的一块拼图:我们并非在研究小鼠独有的现象,而是在触碰人类肥胖症的潜在核心机制。
论文信息
- 标题:Adipocytes orchestrate obesity-related chronic inflammation through β2-microglobulin.
- 论文链接:https://doi.org/10.1038/s41392-025-02486-3
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-12-3
- 期刊/会议:Signal transduction and targeted therapy
- 作者:Jie Li, Yuhao Li, Xiaoyang Zhou, ..., Yuzhang Wu
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
分享



