
捕捉“隐形”杀手:AI 如何在普通平扫 CT 中识破急性主动脉综合征?
在急诊室的生死时速中,急性主动脉综合征(Acute Aortic Syndrome, AAS)不仅是患者的噩梦,也是临床医生的棘手挑战。作为一种包括主动脉夹层、壁内血肿和穿透性溃疡在内的灾难性心血管急症,其凶险程度不言而喻:一旦发病,约有40%至50%的患者会在48小时内死亡,若未得到及时干预,死亡率更是以每小时1%至2%的速度递增。对于这类患者而言,“时间就是生命”绝非一句空话,而是悬在头顶的达摩克利斯之剑。
1. 影像诊断的“两难”困境
当一位急性胸痛患者被送入急诊,医生面临的首要任务是快速鉴别病因。虽然主动脉CT血管造影(CTA)是确诊AAS的“金标准”,具有极高的敏感性和特异性,但在实际临床操作中,它的应用却面临着现实的阻碍。
CTA检查不仅成本高昂,还需要注射碘对比剂,这带来了过敏反应和肾毒性等潜在风险。更重要的是,在我国以及许多发展中国家,受限于医疗资源配置、经济成本以及急诊工作流的限制,医生往往无法对每一位胸痛患者首选CTA检查。绝大多数疑似患者首先接受的是更便捷、更经济的平扫CT(Noncontrast CT)作为初步筛查手段,只有在高度疑似或高风险病例中,才会进一步安排CTA。
然而,这种常规的诊疗路径隐藏着巨大的风险。平扫CT缺乏对比剂的增强显影,主动脉病变的特征在图像上往往“隐晦难辨”。即便是经验丰富的放射科医生,在面对平扫CT图像时,也难以仅凭肉眼准确捕捉到AAS的蛛丝马迹。这就导致了一个核心的科学与临床痛点:在平扫CT作为主要初筛手段的背景下,我们如何防止AAS这一“隐形杀手”被漏诊或误诊,从而避免灾难性的后果?
2. iAorta:赋予平扫CT“透视眼”
为了解决这一难题,来自浙江大学医学院附属第一医院与阿里巴巴达摩院的研究团队合作,在顶刊《Nature Medicine》上发表了一项突破性成果——基于人工智能的AAS预警系统iAorta。这项研究的核心价值在于,它成功训练出了一种深度学习模型,能够直接从普通的平扫CT图像中精准识别AAS,为临床医生提供即时、可解释的预警。
2.1 从“看不清”到“看得准”
研究团队的设计思路非常巧妙。通常情况下,训练AI需要大量的标注数据,而AAS在平扫CT上的病灶往往难以界定。为了解决这个问题,研究人员收集了大量配对的主动脉CTA扫描数据(包含动脉期和平扫期)。他们利用动脉期的高清晰度图像作为“金标准”来确诊AAS并标注病灶区域,然后通过图像配准技术,将这些精准的标注“迁移”到对应的平扫CT图像上,以此来训练模型在平扫图像中识别病变特征的能力。
如图[1]所示,这不仅是一个单一的AI模型,而是一个完整的临床决策支持流程。图a展示了临床的痛点:大量急性胸痛患者首先接受的是平扫CT,通过引入iAorta系统,可以在这一环节直接进行智能筛查。图b则揭示了模型的工作原理:它不仅输出AAS的患病概率,还能生成精确的主动脉壁及真腔分割掩膜(Mask),并生成激活图(Activation Map)。这一点至关重要,因为“黑盒”AI往往难以获得医生的信任,而iAorta通过高亮显示潜在的病变区域(如主动脉壁的增厚或钙化移位),让医生能够直观地看到AI做出判断的依据。
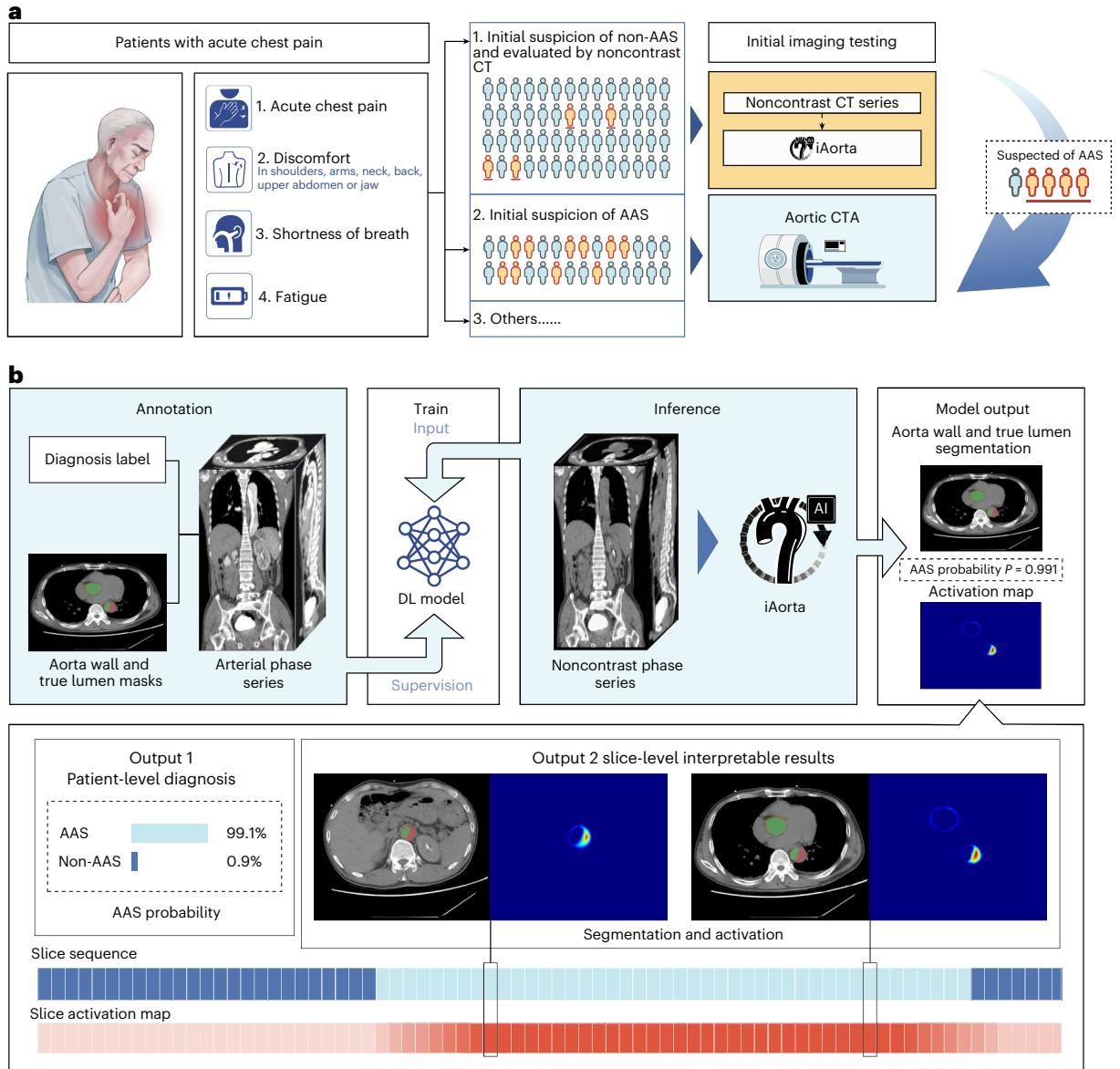
3. 硬核验证:从多中心测试到真实世界大考
一项医疗AI技术若要走出实验室,必须经受住多中心、大规模数据的严苛检验。研究团队为此设计了层层递进的“四步走”验证策略,涵盖了从模型开发到临床部署的全过程。
3.1 跨越地域的稳健性
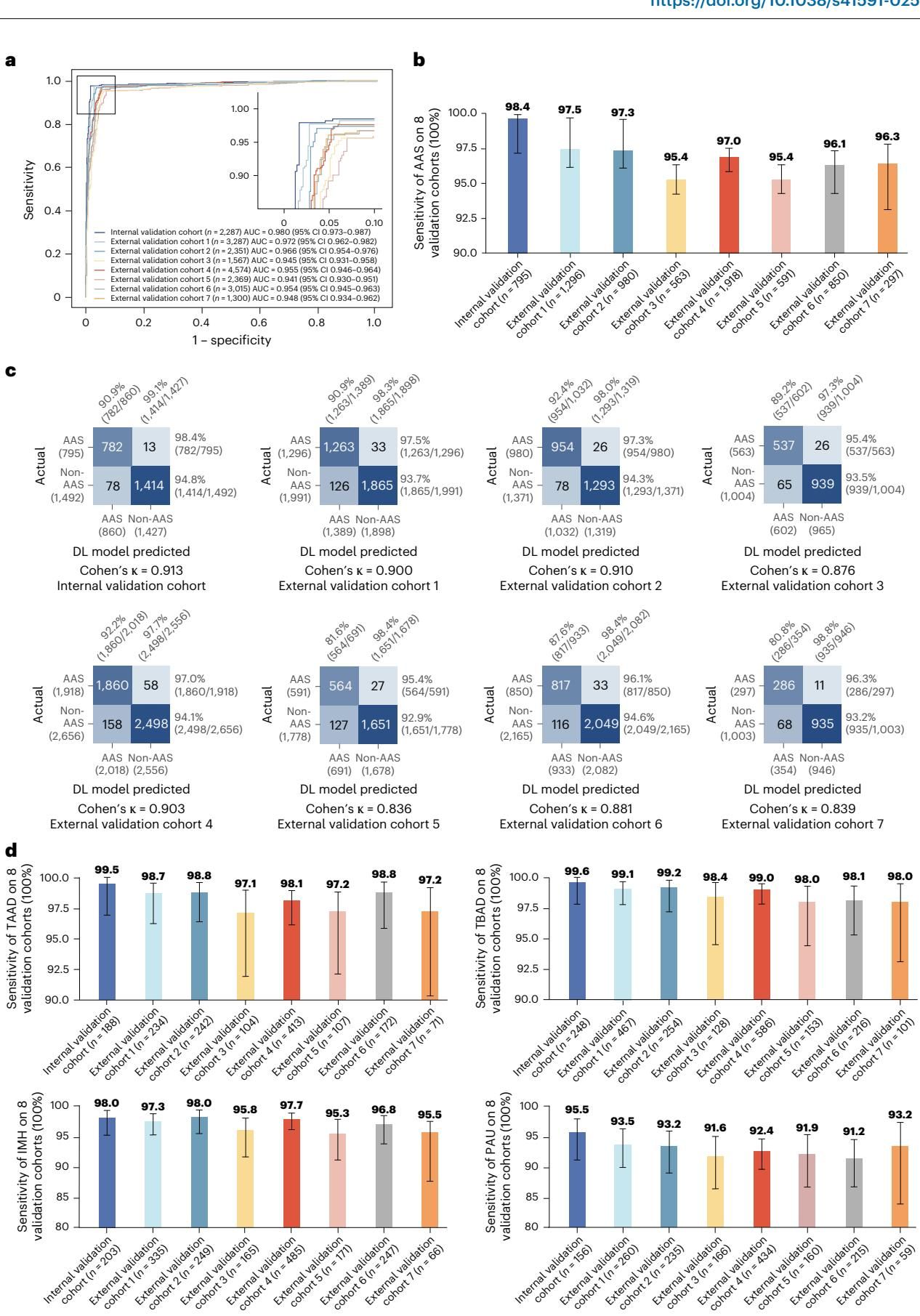
在初步的模型验证阶段,研究者收集了来自中国8家医院的20,750例病例数据。这些数据涵盖了不同的人群特征和扫描设备,是检验AI泛化能力的试金石。结果令人振奋:iAorta在多中心回顾性研究中表现出了极高的稳定性,平均受试者工作特征曲线下面积(AUC)达到了0.958。
如图[2]所示,我们可以清晰地看到AI在各个验证队列中的优异表现。图a展示了模型在内部验证集和7个外部验证集上的ROC曲线,几乎都贴近左上角,意味着极高的真阳性率和极低的假阳性率。而在图b和d中,无论是对于整体AAS的检测,还是针对Stanford A型、B型主动脉夹层(TAAD/TBAD)、壁内血肿(IMH)等亚型,模型都保持了高水平的敏感性。这表明,iAorta并非只会“读死书”,而是真正掌握了识别不同类型病灶的通用特征。
3.2 弥合经验差距:AI 也是最好的导师
在临床实践中,放射科医生的年资和经验往往决定了诊断的准确率,而年轻医生的培养需要漫长的周期。iAorta能否成为缩小这一差距的利器?为此,研究团队组织了一场特别的“人机协作”测试。
他们邀请了11位不同资历的放射科医生(包括心血管专家、主治医生和实习医生)参与阅片。如图[3]所示,结果极具启发性。从图a的散点图中可以发现,在没有AI辅助时(橙色点),实习医生的表现显著低于专家;然而,一旦有了iAorta的辅助(红色三角形),所有医生的诊断敏感性都得到了显著提升。最引人注目的是,在AI的加持下,实习医生的诊断水平甚至逼近了资深专家的基线水平。这说明iAorta不仅是一个报警器,更像一位随时在侧的“超级导师”,能有效弥补经验不足带来的短板。
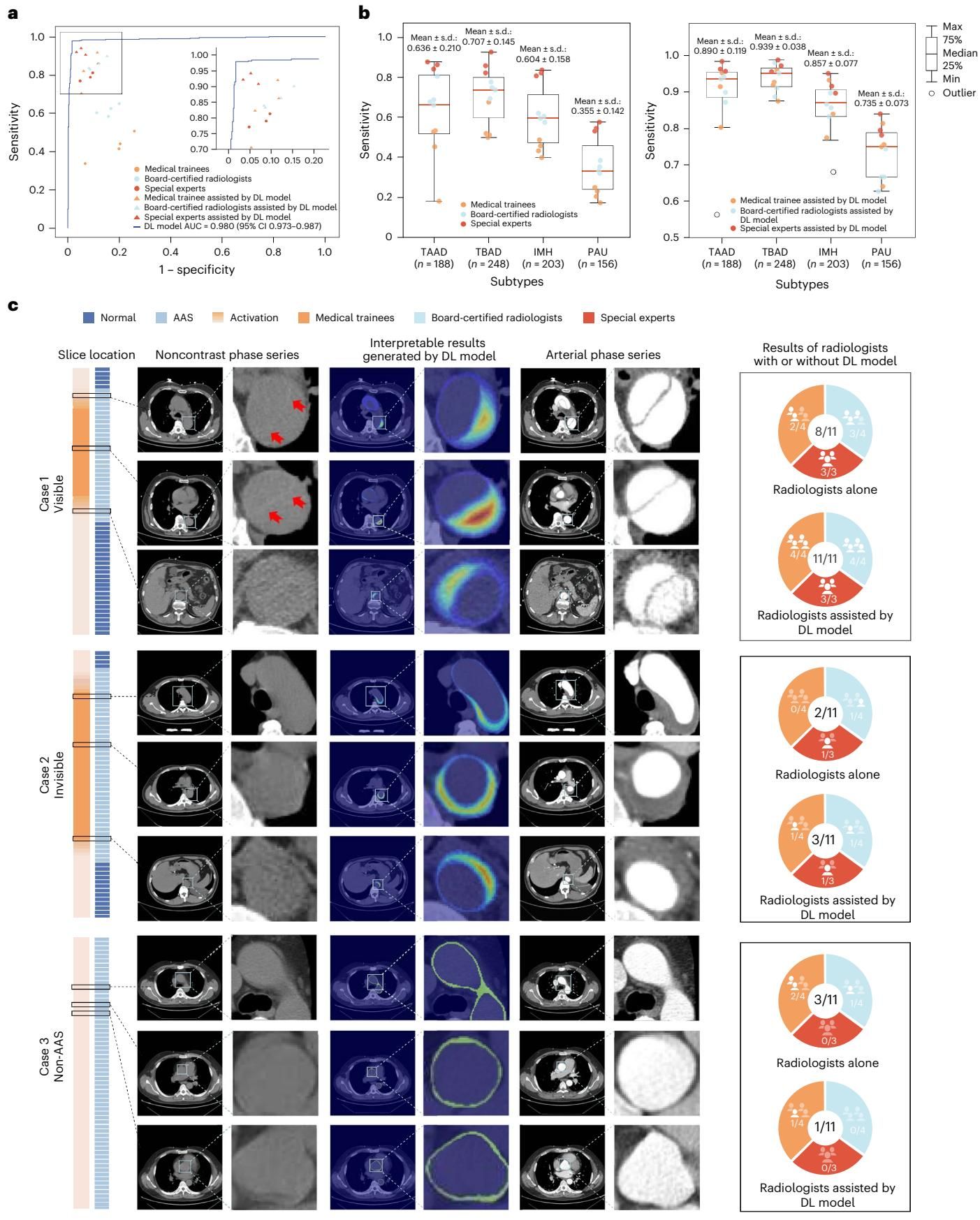
图c更是直观地展示了AI如何“点石成金”。对于一些在平扫CT上肉眼难以察觉的“隐形”病例(Invisible Case),AI通过生成热力图精准定位了病灶区域,引导医生发现了被忽略的线索,从而修正了诊断。
3.3 真实世界的“试金石”
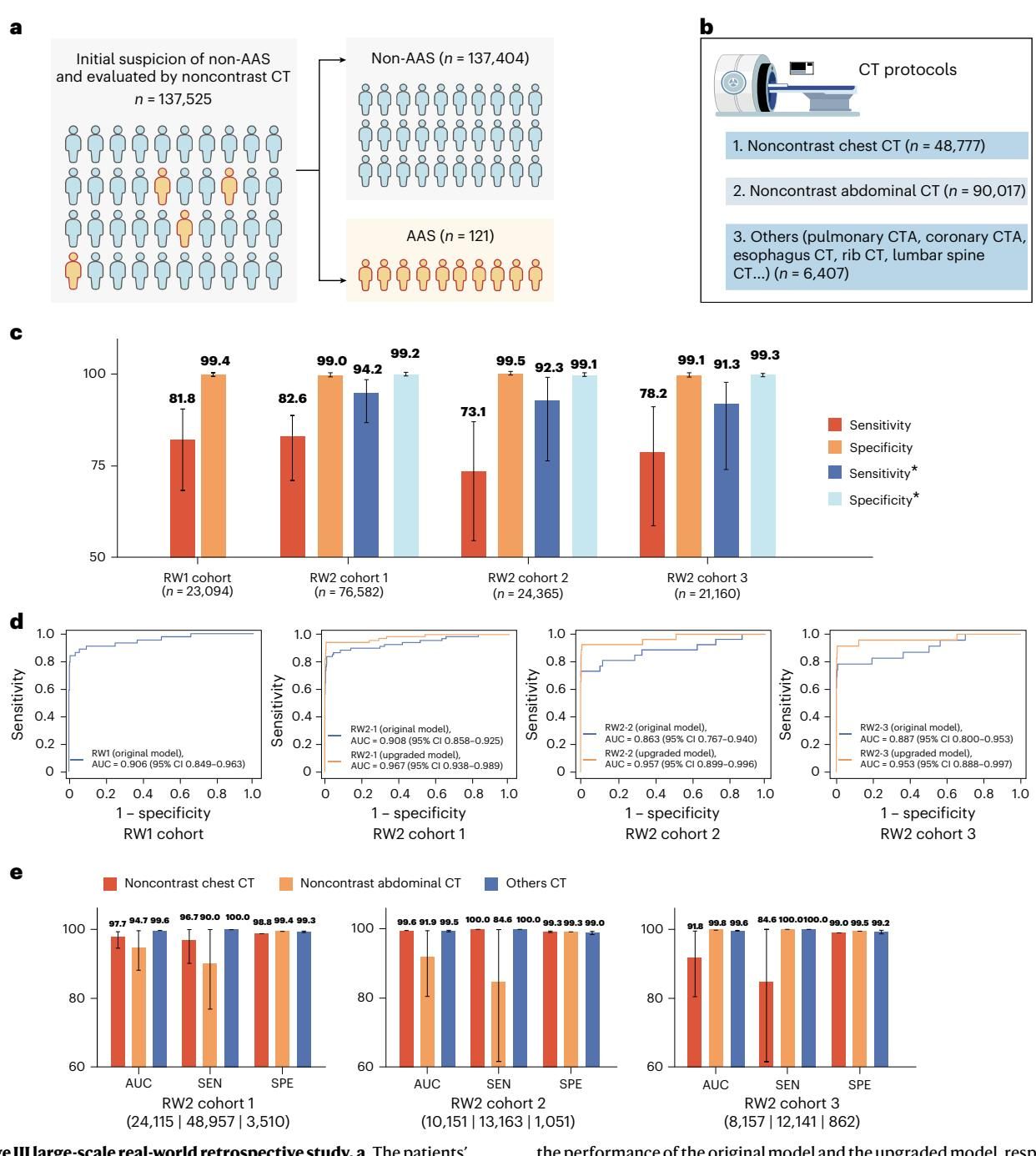
为了进一步挑战极限,研究团队将目光投向了真实世界中最为复杂的场景——涵盖三家医疗中心、超过13万名急诊胸痛患者的回顾性队列。这里的挑战在于,真实世界的数据充满了“噪声”:患者接受的可能是胸部CT,也可能是腹部CT,甚至扫描参数各不相同。
从图[4]中我们可以看到这项大规模研究的宏大图景。图a描绘了庞大的数据筛选漏斗,最终锁定了121例确诊AAS的患者。在这一极具挑战的测试中,经过“困难样本挖掘”和“增量学习”升级后的iAorta模型(图c中蓝色柱状图所示),在不同的验证队列中均展现出了强大的鲁棒性,敏感性维持在0.913至0.942之间,特异性更是高达0.991以上。这意味着,即便是在纷繁复杂的真实急诊数据流中,iAorta依然能像淘金一样,精准地筛出那些高危患者。
4. 抢跑死神:真实急诊室里的“分秒必争”
数据再完美,如果不能转化为临床获益,终究只是纸上谈兵。为了验证iAorta在真实急诊高压环境下的实战能力,研究团队迈出了最关键的一步——前瞻性多中心临床研究。
4.1 诊断时间的“断崖式”缩短
在一项涉及13,846名患者的对比研究中,研究人员将放射科医生分为两组:一组按常规流程独立阅片,另一组则在iAorta的辅助下工作。如图[5]所示,结果呈现出显著的差异。在常规流程中(Group A),初诊放射科医生对平扫CT中AAS迹象的识别敏感性仅为21.4%;而在AI辅助组(Group B),这一数字飙升至78.6%。
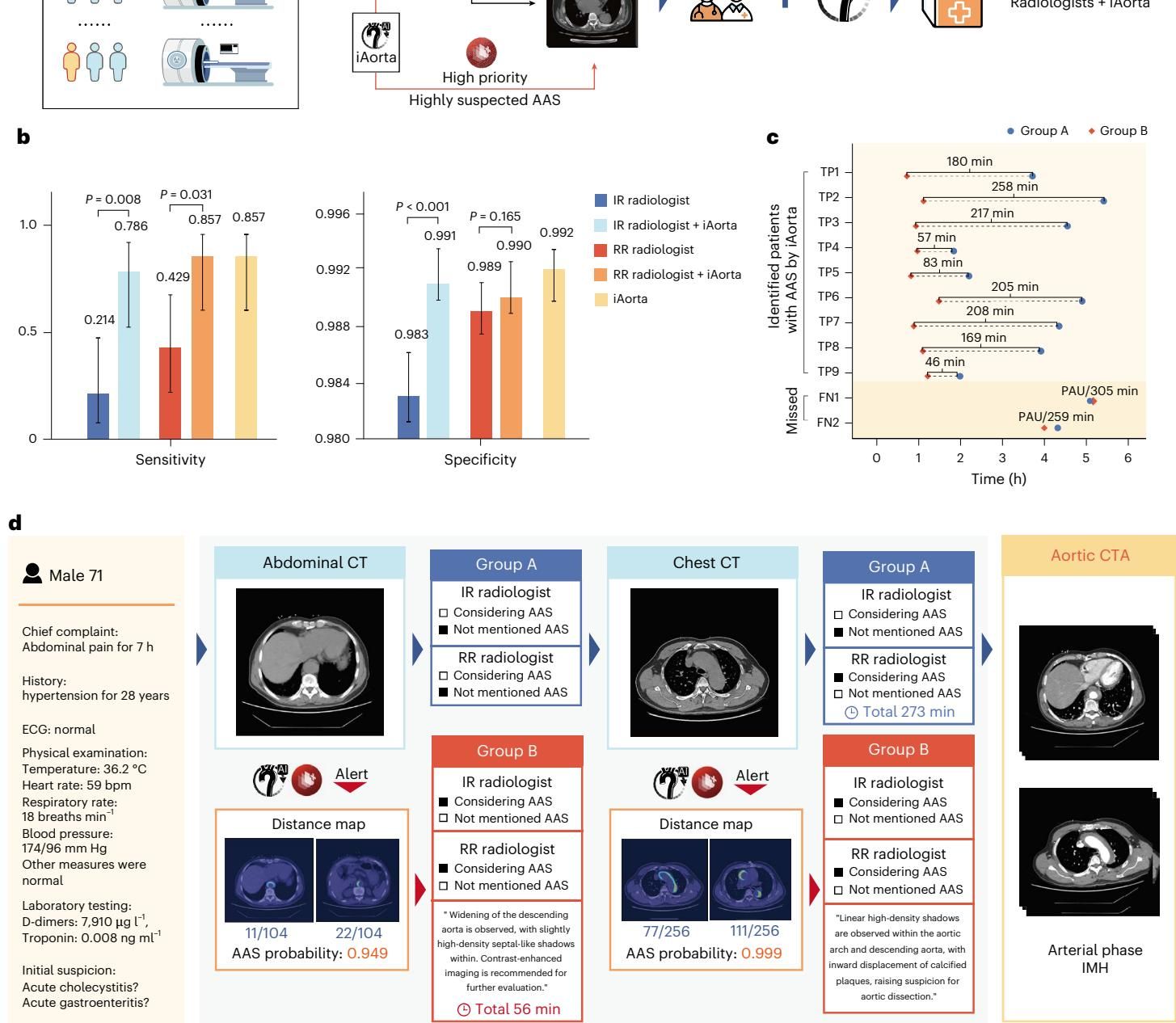
更令人震撼的是时间的节省。对于那些起初被误认为其他疾病的AAS患者,常规流程往往需要数小时甚至数天才能通过反复检查确诊,平均耗时约219.7分钟。而引入iAorta后,系统能在患者完成平扫CT后的几分钟内发出预警,促使医生迅速复核并安排确诊检查,将这一平均确诊时间惊人地缩短至61.6分钟。在主动脉夹层抢救的“黄金时间”里,这节省下来的两个多小时,往往就是生与死的距离。
4.2 挽救“非典型”患者
为了进一步测试系统的实战部署能力,iAorta被集成到了上海长海医院的急诊工作流中进行试点。在为期两个多月的试点中,系统实时监控了15,584名急诊胸痛患者的平扫CT。结果显示,AI成功捕捉到了22例AAS患者中的21例,展现了极高的安全垫作用(图[6])。

其中一个案例尤为典型,生动诠释了AI如何挽救生命。如图[7]所示,一名患者因“右上腹隐痛”来到急诊。根据临床经验,医生首先怀疑的是胆囊炎或胆结石等常见腹部疾病,并开具了腹部平扫CT。按照常规,这名患者可能会在消化科兜兜转转,面临巨大的漏诊风险。然而,iAorta在后台对图像进行分析后,仅仅3分钟内就向医生弹出了红色警报,提示AAS概率高达92.3%,并高亮了腹主动脉沿线的线状高密度影。收到预警的医生立即组织多学科会诊并进行了CTA确诊,最终证实该患者患有Stanford B型主动脉夹层。得益于AI的“吹哨”,这位原本可能要在错误诊疗路径上越走越远的患者,在入院94分钟内就获得了确诊和救治。

5. 结语:医疗AI的普惠未来
这项发表于《Nature Medicine》的研究,不仅展示了一个高性能的AI模型,更提供了一套行之有效的临床解决方案。它证明了,即便是在不依赖昂贵、有风险的增强CT的情况下,利用最普及的平扫CT,结合先进的人工智能技术,也能构筑起一道坚固的AAS筛查防线。
对于医疗资源相对匮乏、CTA设备普及率低或患者经济承受能力有限的地区,iAorta的意义尤为重大。它赋予了基层医院“透视”隐形杀手的能力,让更多AAS患者能在这一凶险疾病发作的初期就被精准识别,从而赢得宝贵的生存机会。随着这类技术的推广,未来的急诊室将拥有一位不知疲倦、火眼金睛的“AI守门员”,为患者的生命安全保驾护航。
论文信息
- 标题:AI-based diagnosis of acute aortic syndrome from noncontrast CT.
- 论文链接:https://doi.org/10.1038/s41591-025-03916-z
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-11
- 期刊/会议:Nature medicine
- 作者:Yujian Hu, Yilang Xiang, Yan-Jie Zhou, ..., Hongkun Zhang
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
References
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/n9326gsxbkdwz3ashgpq8g73_1_7717ead9f7.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/n9326gsxbkdwz3ashgpq8g73_2_c79f1c5cf4.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/n9326gsxbkdwz3ashgpq8g73_3_15cdab3504.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/n9326gsxbkdwz3ashgpq8g73_4_d25a36d530.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/n9326gsxbkdwz3ashgpq8g73_5_7b95254f58.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/n9326gsxbkdwz3ashgpq8g73_6_5616575851.jpg
- https://wilddata-cms-1320403996.cos.ap-shanghai.myqcloud.com/news/articles/20251204/n9326gsxbkdwz3ashgpq8g73_7_270e317cc2.jpg
分享
推荐阅读

MIT开源BoltzGen:AI设计蛋白质药物,向"不可成药"靶点宣战
MIT团队推出开源AI模型BoltzGen,在26个挑战性靶点上实现纳摩尔级结合亲和力,67%成功率打破蛋白质设计困境,免费商用或颠覆制药行业格局。

超加工食品的全球警报:《柳叶刀》揭示人类健康的隐形杀手
覆盖104项研究的综合分析显示,92%的研究证实超加工食品与慢性病相关。这场由跨国食品公司主导的饮食革命,正在成为21世纪最严重的公共卫生威胁之一。

10亿肥胖患者的"救命药",WHO开了绿灯却标上天价
2025年12月1日,世卫组织发布首个GLP-1药物治疗肥胖指南,覆盖司美格鲁肽等三大药物。但年费用上万美元,2030年仅10%患者可及,药企与医保的博弈才刚开始。

Nature专栏——当科研拨款成为政治筹码:特朗普2.0如何改写美国医学研究版图
025年以来,特朗普政府终止了超过3800项NIH和NSF科研拨款,涉及未支付资金约30亿美元。从哈佛大学22亿美元经费被冻结,到RFK Jr叫停5亿美元mRNA疫苗研究,这场史无前例的科研经费削减风暴正在重塑全球医学生物研究格局

Science的研究:AI设计蛋白质"ChatGPT时刻"?4周让T细胞变身抗癌"导弹"
从数年到数周,AI正在重新定义癌症免疫治疗的时间表。丹麦与美国科学家开发的AI平台,能快速设计出"分子钥匙",让患者自身的T细胞精准识别并摧毁肿瘤细胞。