既是抗病毒“急先锋”,又是免疫病“推手”:解读干扰素的致命平衡
感冒发烧时,你是否体验过那种全身酸痛、极度疲惫的感觉?其实,这不完全是病毒在捣鬼,而是你的免疫系统正在“真刀真枪”地干活。这种防御反应的核心指挥官,就是我们今天的主角——干扰素(Interferons, IFNs)。
作为人体免疫系统的“吹哨人”,干扰素在发现病毒入侵的第一时间就会拉响警报,构筑防线。然而,医学界发现了一个令人不安的现象:这位抗病毒的“大英雄”,在某些情况下会摇身一变,成为摧毁健康的“破坏王”。研究显示,高达80%的系统性红斑狼疮(SLE)患者体内,都存在持续且异常活跃的干扰素信号,这种信号不再针对病毒,而是开始攻击自身的组织器官。
为什么同一个分子,既能是守护生命的卫士,又能变成引发自身免疫病、甚至协助癌细胞逃逸的帮凶?从抗病毒到抗癌,再到治疗免疫性疾病,我们该如何驾驭这把“双刃剑”?本文将带你一探究竟。
1. 免疫系统的“通讯兵”:干扰素是如何工作的?
干扰素最早于1957年被科学家发现,因其能“干扰”病毒复制而得名。但随着研究的深入,人们发现它的本事远不止于此。它实际上是一类功能强大的细胞因子,就像军队中的通讯兵,负责在细胞之间传递作战指令。
1.1 家族庞大,分工明确
干扰素家族并不是“单兵作战”,而是分为三大类,各司其职:
- I型干扰素(如IFN-α, IFN-β):分布最广,几乎所有有核细胞都能产生,主要负责全面抗病毒。
- II型干扰素(IFN-γ):主要由免疫细胞(如T细胞、NK细胞)产生,是免疫调节的“重炮手”。
- III型干扰素(IFN-λ):专注于呼吸道和肠道等黏膜表面的防御,主打“局部战争”,避免引起全身性的过度炎症。
1.2 它是如何传达“军令”的?
当细胞探测到病毒入侵时,会释放干扰素。这些干扰素会找到邻近细胞表面的特定“接收器”(受体),一旦结合,就会触发细胞内部的一系列连锁反应。其中最经典的不仅是“JAK-STAT”信号通路,这是一条从细胞膜直通细胞核的高速公路。
如图[1]所示,干扰素(Type I, II, III)分别结合其特异性受体(如IFNAR1/2, IFNGR1/2等),这就像钥匙插进了锁孔。紧接着,受体上的JAK激酶(JAK1, TYK2等)被激活,它们就像接力赛的第一棒,将信号传递给STAT蛋白。STAT蛋白两两配对(二聚化),携带指令进入细胞核,找到特定的DNA片段(ISRE或GAS),从而启动成百上千个“干扰素刺激基因”(ISGs)的表达。这些基因产物,就是真正的“抗病毒部队”,负责阻断病毒复制或调节免疫反应。

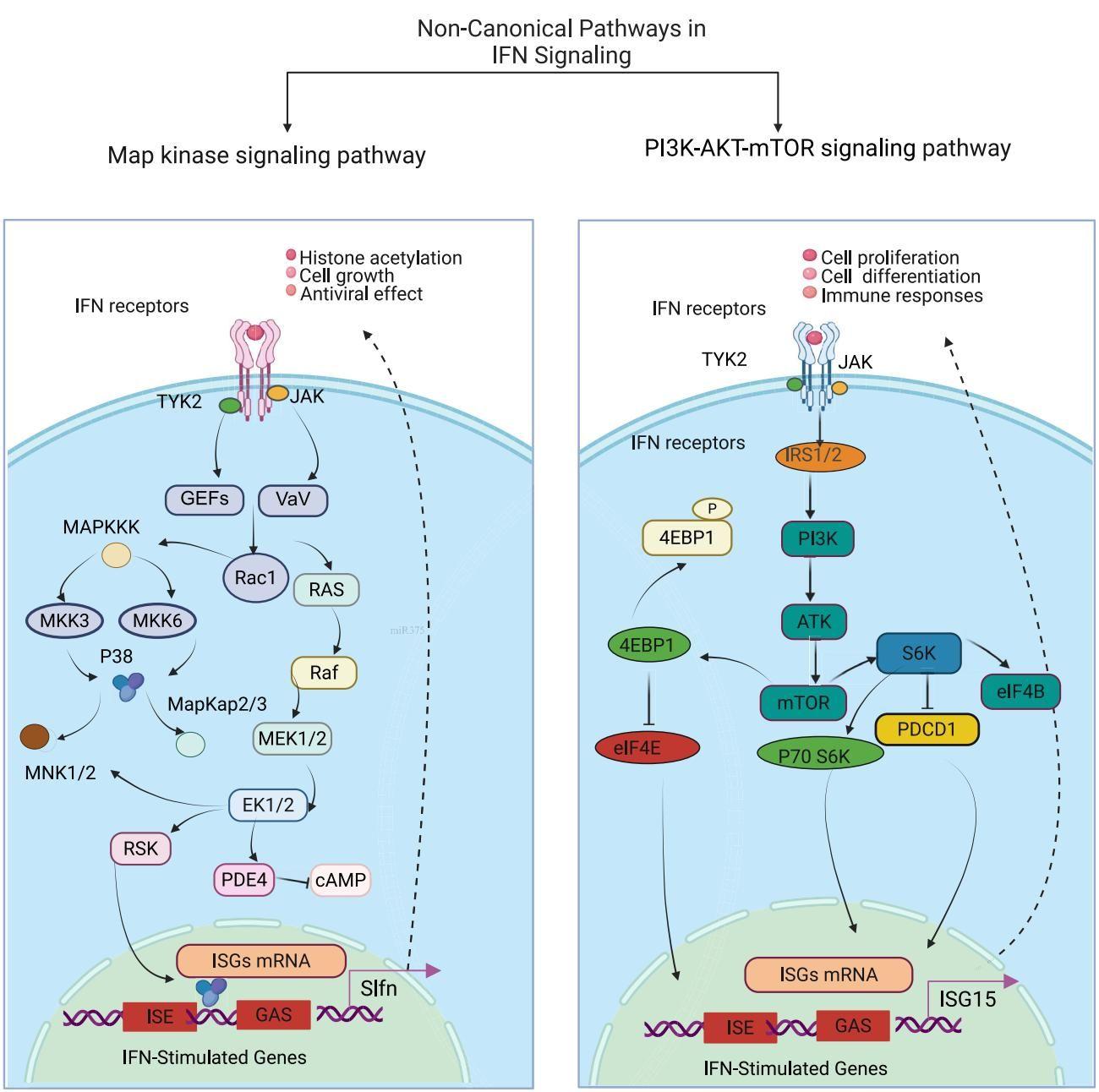
值得注意的是,除了这条主路,干扰素还有“辅路”可走。如图[2]所示,干扰素还能激活非经典的MAPK通路和PI3K-AKT-mTOR通路。我们可以看到,受体激活后能通过GEFs和Vav激活Rac1和Ras,进而启动MAPK级联反应,调节组蛋白乙酰化和细胞生长;同时也能通过IRS1/2激活PI3K,最终影响mRNA的翻译(如ISG15)。这些辅路负责微调细胞的代谢和生存状态,确保免疫反应的精准度。
2. 守护防线:干扰素的三大“看家本领”
在健康状态下,干扰素维持着极低的基础水平,时刻准备着应对突发状况。一旦“敌军”来袭,它会迅速启动三大防御机制。
2.1 铁壁铜墙:直接封锁病毒复制
干扰素最直接的作用就是让细胞进入“抗病毒状态”。
从图[3]中我们可以清晰地看到这一过程:当受感染细胞察觉到病毒(如dsRNA)时,会通过TLRs或RIG-I等侦察兵诱导干扰素的产生。分泌出的干扰素作用于周边细胞,激活JAK-STAT通路,大量合成抗病毒蛋白(ISGs)。这些蛋白各显神通:

- ISG15:像标签一样贴在病毒蛋白上,破坏其稳定性。
- Mx蛋白:像手铐一样锁住病毒的零部件,阻止其组装。
- OAS和PKR:前者能切碎病毒的遗传物质RNA,后者能直接叫停蛋白质合成工厂,从源头上“饿死”病毒。
2.2 招兵买马:激活免疫大军
除了单兵作战,干扰素还擅长“摇人”。
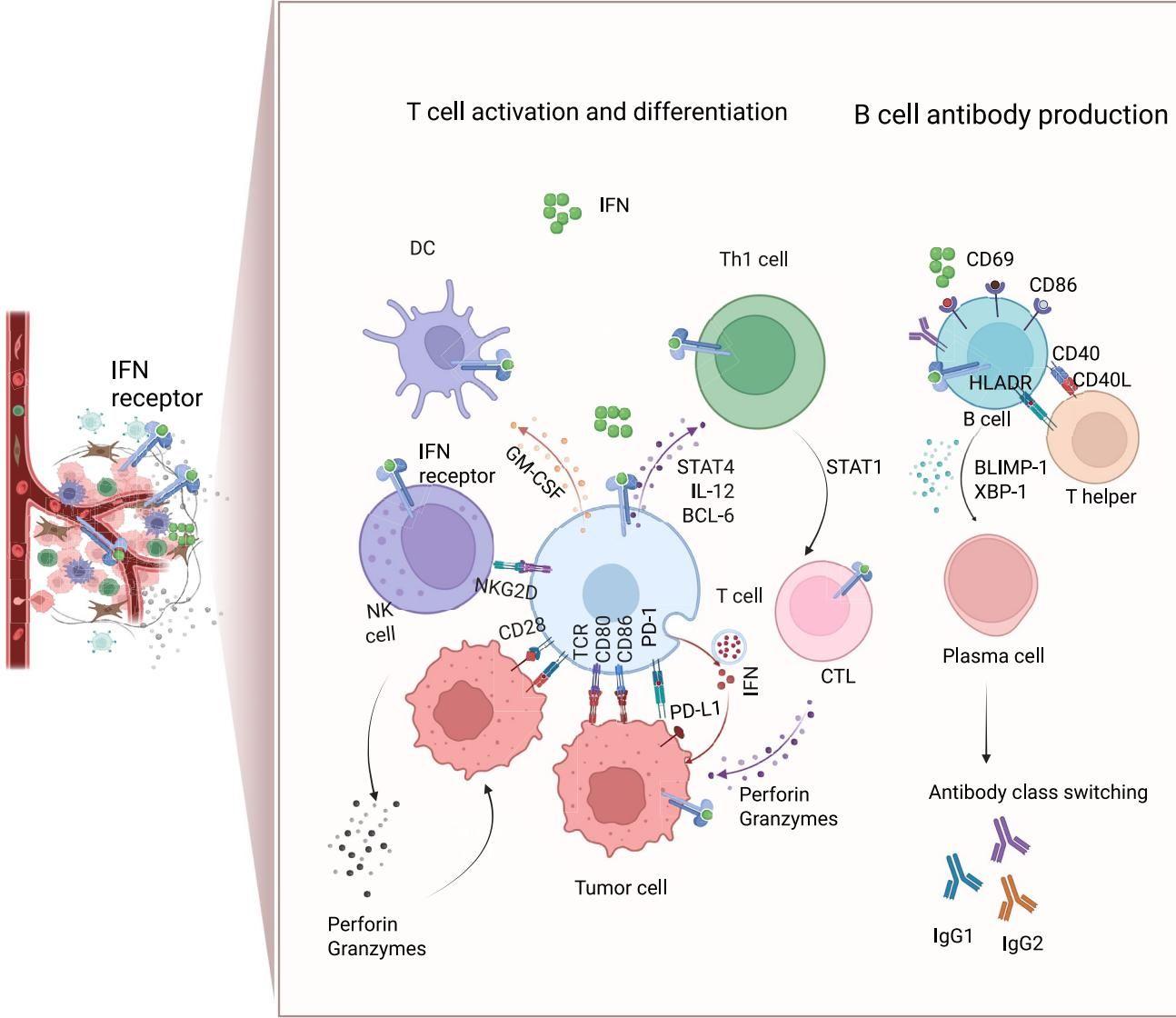
它能促进树突状细胞(DC)成熟,让它们更高效地向T细胞“汇报敌情”(抗原递呈)。如图[4]所示,在干扰素的刺激下,DC细胞变得“更有经验”,T细胞迅速分化为具有杀伤力的效应T细胞(CTL),NK细胞也被激活释放穿孔素和颗粒酶,直接爆破被感染的细胞。同时,图[4]右侧还展示了干扰素如何指挥B细胞:它上调B细胞表面的CD40、CD86等分子,促进其与T细胞的互动,最终分化为浆细胞,生产特定的抗体(如IgG1, IgG2),实现精准打击。
2.3 围剿肿瘤:不仅杀毒,还能抗癌
干扰素在抗癌战场上同样表现不俗。它能直接逼迫癌细胞“自杀”(细胞凋亡),切断癌细胞的血管补给(抗血管生成),更重要的是,它能通过上调MHC分子,撕下癌细胞的伪装,让免疫系统更容易发现并消灭它们。
3. 致命的失衡:当守护者变成破坏者
正所谓“过犹不及”,当干扰素信号持续时间过长或强度过大时,这位昔日的守护者就会黑化,变成破坏组织稳态的元凶。这种“好心办坏事”的现象,在多种严重疾病中都能看到它的身影。
3.1 自身免疫病的“内战”
在系统性红斑狼疮(SLE)等自身免疫病中,免疫系统仿佛杀红了眼,分不清敌我。研究发现,这种混乱往往始于干扰素的持续高表达。
如图[5]顶部的“自身免疫发病机制”所示,这是一个自我放大的恶性循环:树突状细胞(DC)异常激活辅助性T细胞(如Th17),导致干扰素受体持续受到刺激。这种刺激不仅诱导了CXCL9和CXCL10等趋化因子的释放,像磁铁一样吸引更多的T细胞和NK细胞聚集,还促进了IL-1β和IL-6等促炎因子的爆发。结果就是,免疫大军在没有外敌的情况下,对自己人发动了猛烈攻击,导致组织损伤。

3.2 神经系统的“风暴”
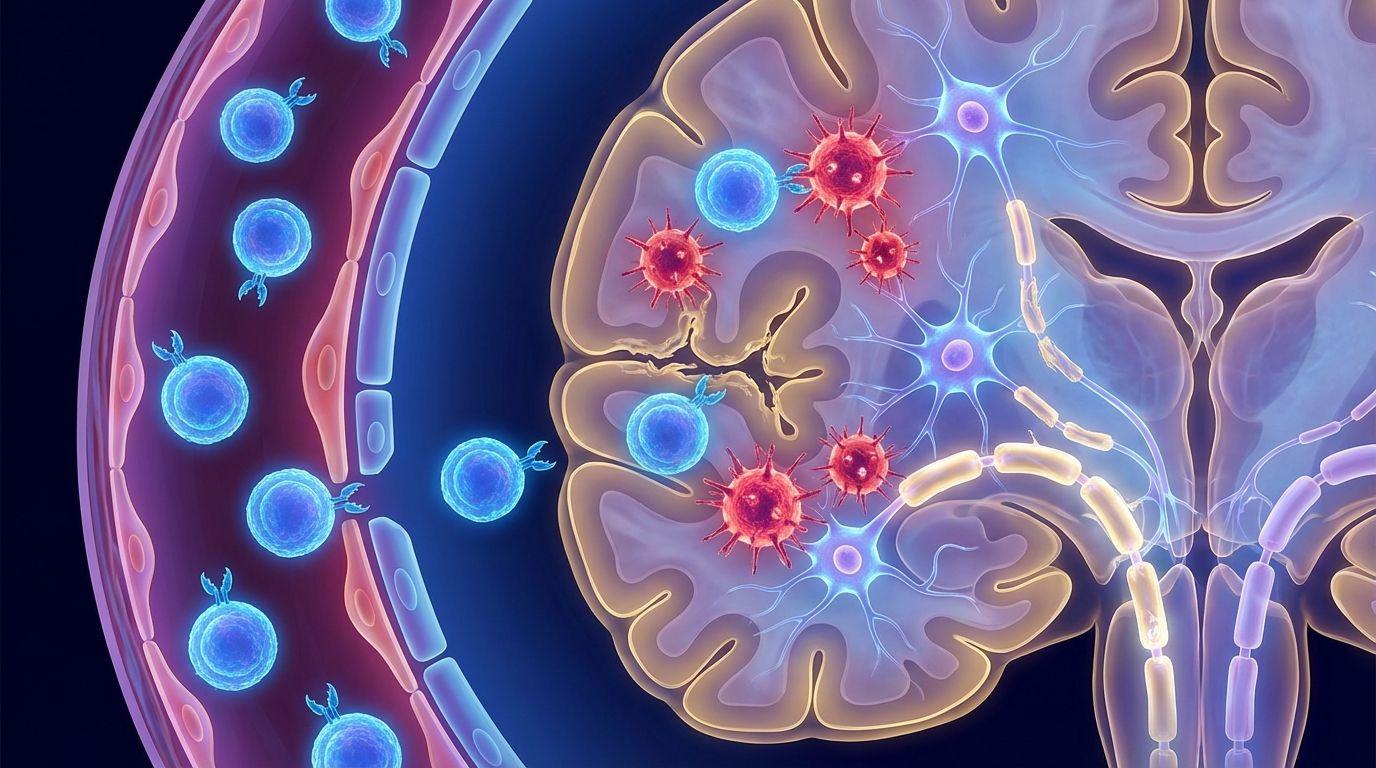
在大脑这个精密的指挥中心,干扰素的失控同样致命。在帕金森病(PD)和阿尔茨海默病(AD)中,干扰素不再是保护神经的屏障,而是变成了神经炎症的推手。
观察图[5]中间的“神经炎症”部分,我们可以看到一个令人揪心的过程:在外周T细胞和大脑内的小胶质细胞(Microglia)的影响下,干扰素受体被激活,进而刺激星形胶质细胞产生大量的炎症因子(IL-1β, TNF-α)。更糟糕的是,干扰素诱导的IFITM3蛋白会促进β-淀粉样蛋白(Aβ)的聚集,这些斑块是阿尔茨海默病的标志性病理特征,它们最终导致了神经元的死亡和认知功能的衰退。
3.3 肿瘤的“伪装术”与血管的“锈蚀”
癌细胞非常狡猾,它们能利用慢性的干扰素信号来为自己打掩护。如图[5]中的“肿瘤免疫逃逸”面板所示,长期的干扰素刺激虽然在一开始能招募T细胞,但随后它会诱导肿瘤细胞表面表达PD-L1,这是一种“刹车分子”,能让杀伤性T细胞(T cell)熄火。同时,它还上调IDO1酶,消耗掉T细胞生存必需的营养,让免疫卫士精疲力竭。此外,SOCS2等负调节因子的出现,也进一步抑制了正常的免疫激活信号。
不仅如此,干扰素还在悄悄破坏我们的血管。图[5]底部的图示揭示了动脉粥样硬化的另一面:干扰素受体的激活抑制了内皮一氧化氮合酶(NOS3),导致保护血管的一氧化氮(NO)减少,同时增加了粘附分子(VCAM-1)和趋化因子(MCP-1),让炎性细胞更容易粘附在血管壁上,加速斑块形成。
4. 驯服“猛兽”:前沿治疗策略
既然看清了干扰素在不同情境下的两面性,科学家们制定了“抑恶扬善”的治疗策略,旨在精准调控这把双刃剑。
4.1 传统兵法:缺了就补,多了就挡
最基础的策略是简单的“加减法”。
- 替代疗法(加法):对于病毒感染或某些癌症,我们需要援军。如图[6]中间的“IFN制剂”部分所示,通过注射重组干扰素(如IFN-α2a/b)或长效的PEG化干扰素,可以直接增强CTL细胞的杀伤力,并通过TCR/MHC复合物更好地识别肿瘤。

- 抑制疗法(减法):对于自身免疫病,则需要“撤火”。JAK抑制剂(如鲁索替尼、巴瑞替尼)能切断干扰素信号传导的必经之路,从而平息过度的免疫反应。
4.2 精准医疗:量体裁衣
每个人的基因不同,对干扰素的反应也千差万别。这就是“精准医疗”的用武之地。如图[6]左侧所示,科学家发现特定的单核苷酸多态性(SNPs)会影响干扰素受体或下游激酶(JAK)的功能。通过检测这些基因标记,医生可以预测患者对干扰素治疗是否敏感,从而制定个性化的给药方案,避免无效治疗。
4.3 联合疗法:1+1>2
单一疗法往往独木难支,联合出击才是王道。图[6]右侧展示了极具潜力的“组合拳”:将干扰素与免疫检查点抑制剂(如抗PD-1/PD-L1抗体)或靶向药物(如西妥昔单抗)联用。这种策略一方面利用干扰素激活DC细胞和T细胞,另一方面利用抗体解除肿瘤的免疫抑制(如阻断PD-1与PD-L1的结合),从而克服耐药性,实现对肿瘤的双重打击。
5. 结语:在平衡中寻找生机
干扰素的故事,本质上是关于“平衡”的哲学。它是人体演化出的精妙防御机制,既能雷霆万钧地扫荡病毒,也可能因一时失控而伤及自身。从最初的广谱抗病毒药,到如今自身免疫病的靶点,再到肿瘤免疫治疗的得力助手,我们对干扰素的认知正在不断重塑。
未来的医学,不再是简单地通过注射干扰素来“抗毒”,而是通过基因编辑、精准抑制和联合用药,在微观层面精细调节免疫系统的“音量”。既不让它由于沉默而放过癌细胞,也不让它因为喧嚣而引发自身免疫风暴。这不仅是科学的挑战,更是人类追求健康长寿的必经之路。
论文信息
- 标题:Interferon signaling pathways in health and disease.
- 论文链接:https://doi.org/10.1186/s43556-025-00381-5
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-12-8
- 期刊/会议:Molecular biomedicine
- 作者:Chunli Wen, Qingzhan Lan, Yunshan Wang, ..., Duanrui Liu
本文由超能文献“资讯AI智能体”基于4000万篇Pubmed文献自主选题与撰写,并经AI核查及编辑团队二次人工审校。内容仅供学术交流参考,不代表任何医学建议。
分享