
Nature重磅:大脑如何一边睡觉一边警戒?慢波同步构建“可击碎”的感官屏障
睡眠是生命体最基础的生理需求之一,也是神经科学领域最迷人的谜题。我们都知道,为了进行必要的生理修复,动物必须经历一段不受干扰的休息时间。这就带来了一个经典的生物学悖论:睡眠要求大脑将个体与外部世界“断连”,以屏蔽无关的感官干扰;但与此同时,为了生存,大脑又必须保持一定程度的警惕,随时准备对捕食者或其他突发的危险信号做出反应。
这究竟是如何做到的?大脑是如何在“关机”与“待机”之间找到那个微妙的平衡点?
长期以来,科学家们认为哺乳动物丘脑的中继站是过滤感官信息的关键,且深度睡眠期间广泛存在的同步慢波活动(SWA)起到了核心作用。然而,这种机制在神经回路层面的具体运作方式,尤其是如何在维持静止行为的同时保留对显著刺激的反应能力,一直未被完全解构。近期,发表在《Nature》上的一项研究 Network synchrony creates neural filters promoting quiescence in Drosophila [[ref_id:null]],利用果蝇这一强大的模式生物,精妙地揭示了这一机制的核心:一种由神经网络同步产生的“可击碎”的神经过滤器。
1. 寻找睡眠的“节拍器”:跨网络的慢波同步
要理解大脑如何过滤信息,首先要找到控制睡眠状态的神经信号。研究团队将目光锁定在果蝇大脑的中心复合体(Central Complex),这是一个负责整合感官信息、导航和运动控制的关键区域。早前的研究已经发现,果蝇中心复合体中的R5神经元网络在睡眠需求增加时会表现出特定的电活动——慢波活动(SWA,0.5-1.5 Hz)。
但是,R5并非孤立工作。研究人员通过双色电压成像技术,同时监测了R5神经元和其上游的背侧扇形体(dFSB)——一个已知的睡眠稳态调节中心。
如图[1]所示,研究人员在活体果蝇中观察到,dFSB和R5的神经活动在夜间表现出显著的同步性。图中清晰地展示了dFSB(深灰色区域)和R5(蓝色区域)的解剖位置及电压指示剂的表达情况。左下角的宽场图像和右侧的电活动记录显示,相比于早晨(金色太阳图标),夜间(黑色月亮图标)这两个网络的活动相关性显著增加,且慢波功率在夜间大幅提升。这表明,随着昼夜节律和睡眠压力的变化,大脑内部正在形成一种跨网络的协同振荡,这种低频的同步活动就像一个“节拍器”,为睡眠状态的建立奠定了基础。
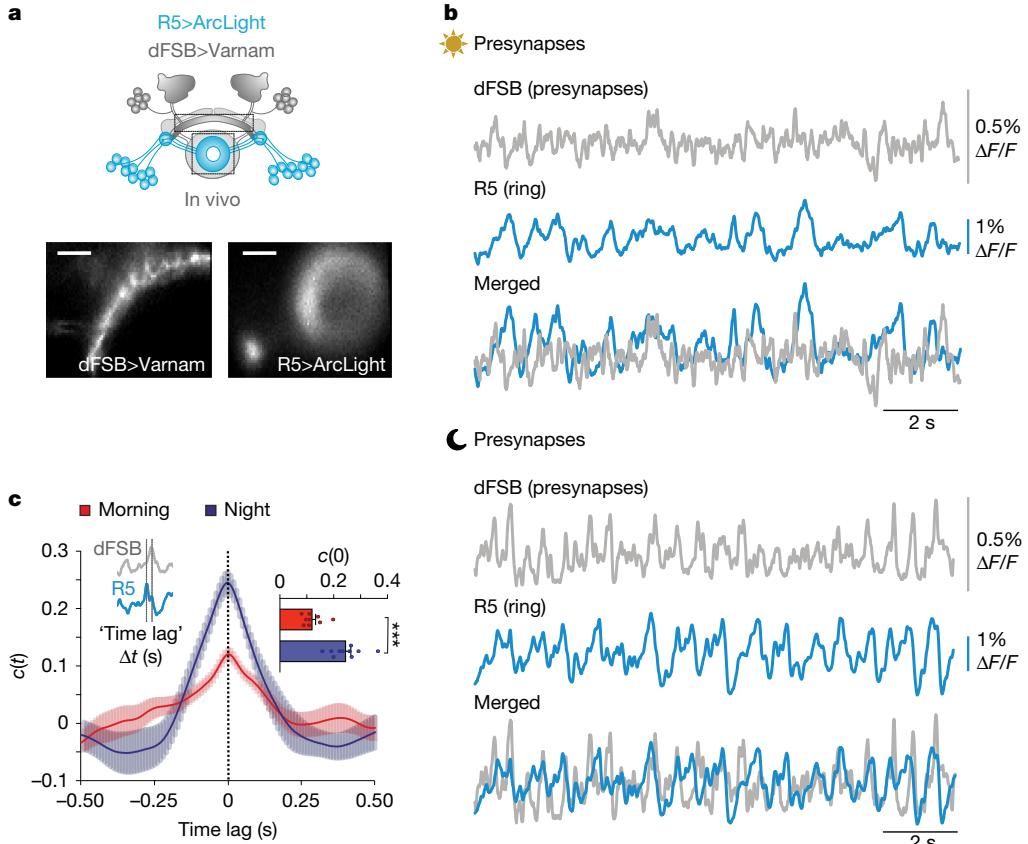
有趣的是,这种同步不仅仅是简单的“一起放电”。光遗传学实验进一步证实,dFSB在夜间的活跃可以“开启”R5网络的相干振荡,这种层级化的控制揭示了大脑如何根据时间(昼夜节律)和疲劳程度(稳态驱动)来主动调节内部状态。
2. 谁在以此为号?睡眠网络与运动网络的“握手”
如果说SWA是睡眠的信号,那么它如何抑制运动?这就涉及到另一个关键角色——Helicon细胞。这是一种促进运动并传递视觉信号的神经元。解剖学分析发现,R5神经元与Helicon细胞之间存在密集的突触连接,但令人困惑的是,它们在早晨似乎“形同陌路”。
为了解开这个谜题,研究者深入探究了这两个网络在不同时间段的互动模式。
2.1 夜幕下的共舞:从“形同陌路”到“步调一致”
实验结果令人大开眼界。如图[2]所示,虽然R5神经元(蓝色轨迹)与Helicon细胞(灰色轨迹)在解剖上紧密相连,但在早晨,它们的电活动几乎是互不相关的(Morning)。然而,到了夜晚(Night),情况发生了戏剧性的变化:这两个网络的活动表现出了高度的同步性,相关系数显著增加。这种同步并非偶然,而是受到了生物钟和睡眠稳态(即“困意”)的双重调控——图中数据显示,如果你剥夺果蝇的睡眠,即便在早晨,这两个网络也会被强行拉入这种同步状态。
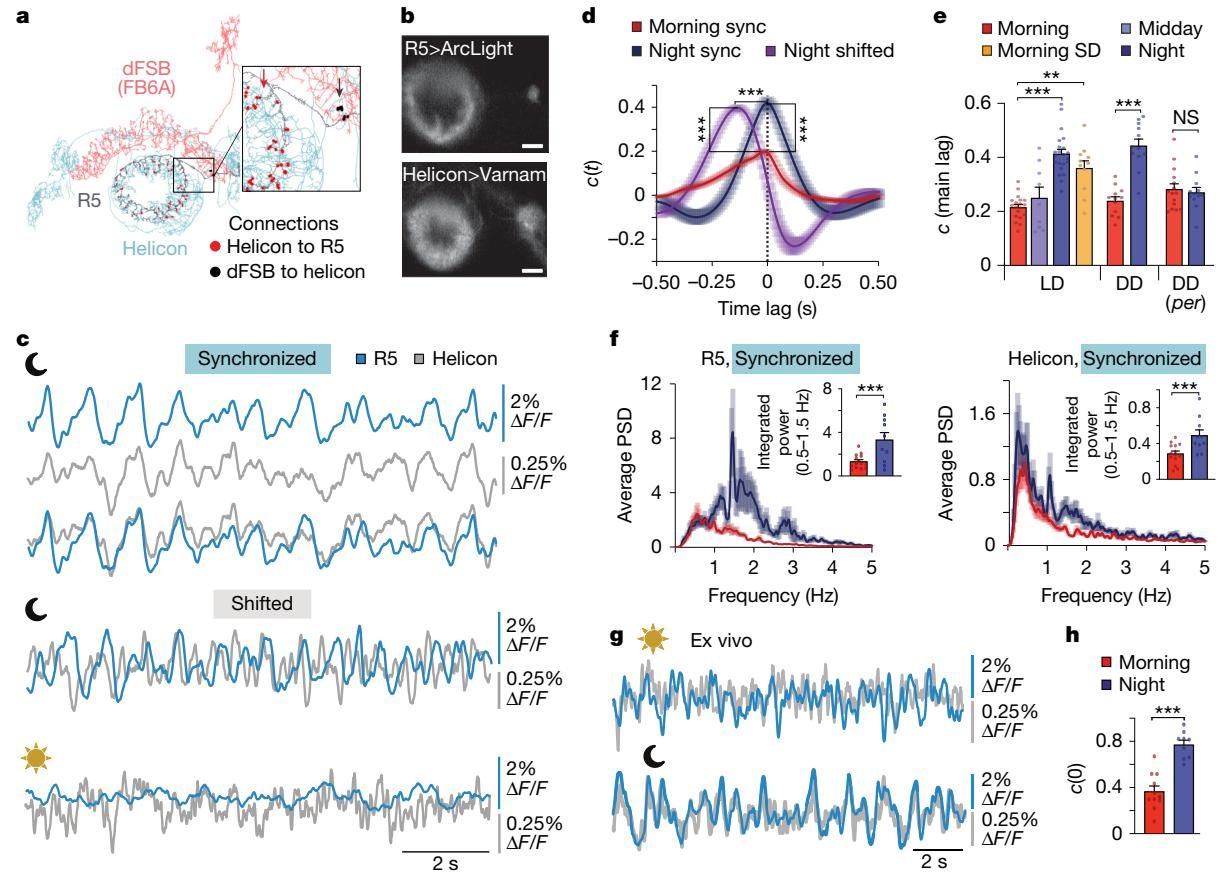
这种同步有什么意义?研究者通过计算模型和光遗传学实验发现,R5网络在夜间通过其混合的兴奋性和抑制性输出,有效地“接管”了Helicon细胞。Helicon本应负责传递视觉信号并驱动运动,但在夜间,它被R5的慢波节奏所裹挟,进入了一种低反应性的震荡状态。这就像是R5给Helicon戴上了“降噪耳机”,使其对普通的感官输入不再敏感,从而抑制了果蝇的自主运动,诱导其进入静止状态。
3. “可击碎”的过滤器:拮抗信号的精妙平衡
既然运动被抑制了,那为什么强烈的刺激还能唤醒我们?这就触及了本研究最核心的发现——一种基于“拮抗输入”的神经门控机制。
研究团队追踪了R5和Helicon的下游目标,发现它们都汇聚到了同一群神经元上——EPG神经元(Ellipsoid Body-Protocerebral Bridge-Gall neurons)。EPG神经元是果蝇大脑中的“指南针”,负责编码方向和导航,是连接感知与运动的重要枢纽。
如图[3]所示,R5和Helicon在EPG神经元上的突触连接位置惊人地接近(图b),仿佛是特意安排的“近身肉搏”。更关键的是,它们发出的指令是截然相反的:Helicon试图兴奋EPG神经元(去极化,发出“前进”指令),而R5则试图抑制它(超极化,发出“停止”指令)。从图中记录的电位变化可以看到,Helicon的激活会导致EPG膜电位显著上升,而R5的激活则使其下降。这两种力量在夜间形成了一种动态的拉锯战。
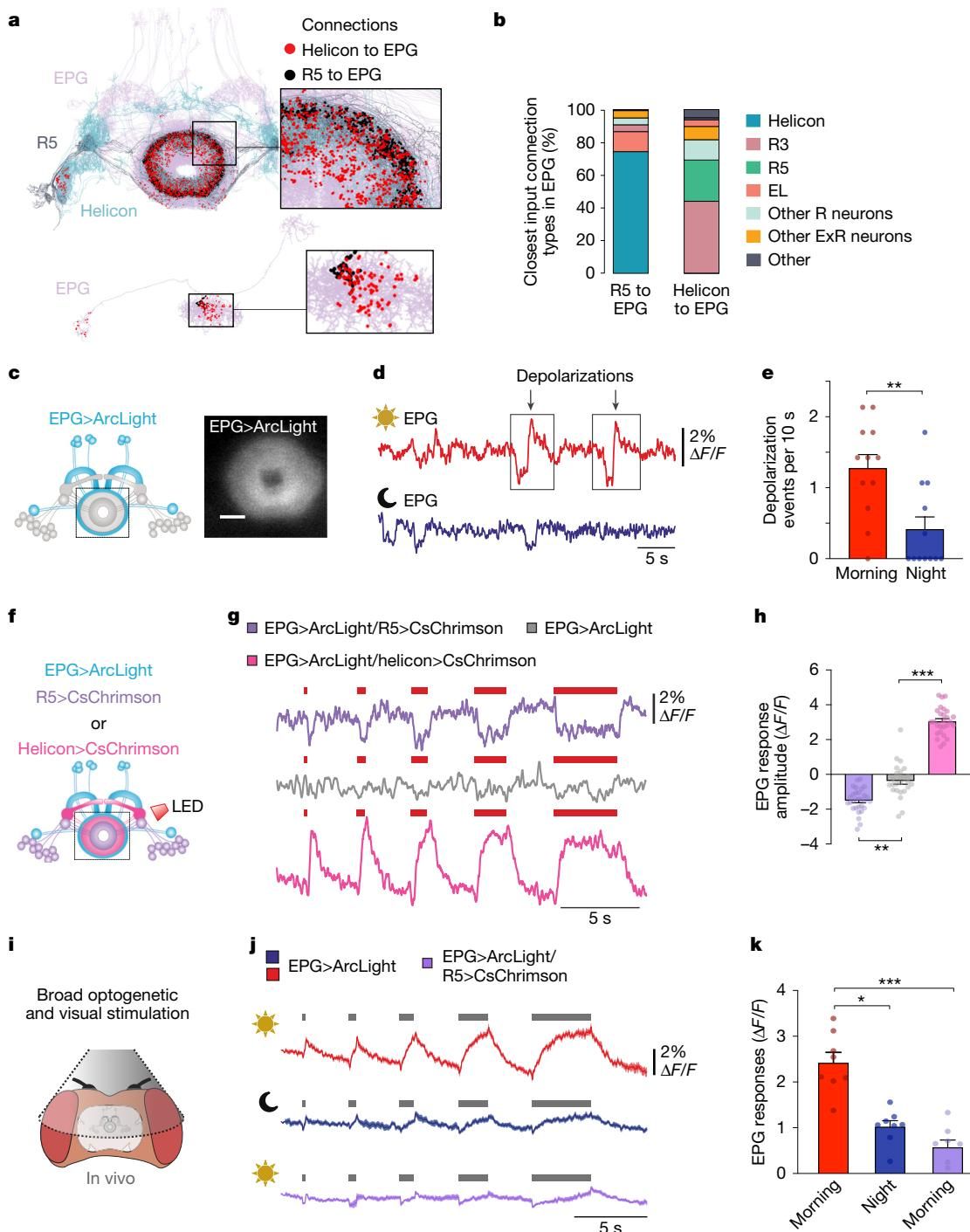
在夜间,随着R5与Helicon形成同步的慢波振荡,R5发出的抑制性信号周期性地抵消了Helicon传递的视觉兴奋信号。这种机制构建了一个动态的“神经过滤器”:
- 过滤弱刺激:对于普通的视觉背景噪音或微弱的光线变化,R5的抑制作用占据主导,信号无法有效传递给EPG,果蝇因此能保持安睡,不被环境中的琐碎细节打扰。
- 保留强反应:对于强烈的突发刺激(如刺眼的强光或突然的气流),强大的感官输入能够瞬间打破这种由慢波维持的脆弱平衡,冲破R5的抑制,强行激活EPG系统。这就解释了为什么这种过滤器是“可击碎”的(Breakable)——它不是一道锁死的铁门,而是一道允许紧急信号通过的智能屏障。
这种设计堪称进化的杰作:它既保证了睡眠的连续性,又没有牺牲动物对危险的感知能力,完美解决了“休息”与“警戒”之间的矛盾。
4. 展望:从果蝇看大脑的通用逻辑
这项研究不仅精细地解构了果蝇大脑中的睡眠回路,更为我们理解神经系统如何处理信息提供了一个通用的视角。它告诉我们,睡眠并非仅仅是被动的“断电”,而是一种由特定的神经振荡(SWA)主动构建的动态状态。这种状态利用时间上的同步性(Coherence)作为一种计算资源,创造出了灵活的感官过滤器。
更有趣的是,研究人员还观察到了一种介于完全同步和去同步之间的“偏移状态”(Shifted State),即Helicon的活动略微领先于R5。这可能代表了过滤器的一种“半开”模式,或者是一个允许感官信息重新流入、引导动物苏醒的过渡阶段。这种状态的存在暗示了大脑在睡眠与觉醒之间可能存在更丰富的中间态,值得未来进一步探索。
从果蝇的中心复合体到哺乳动物的丘脑皮层系统,利用同步振荡来门控信息似乎是大脑进化的某种共识。随着我们对这些微观神经机制理解的加深,或许未来不仅能解开睡眠的全部奥秘,还能为治疗睡眠障碍或注意力缺陷提供全新的神经调控思路。毕竟,只有学会如何优雅地“屏蔽”世界,大脑才能真正拥有掌控世界的能力。
论文信息
- 标题:Network synchrony creates neural filters promoting quiescence in Drosophila.
- 论文链接:https://doi.org/10.1038/s41586-025-09376-2
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-10
- 期刊/会议:Nature
- 作者:Davide Raccuglia, Raquel Suárez-Grimalt, Laura Krumm, ..., David Owald
本文由超能文献AI辅助创作,内容仅供学术交流参考,不代表任何医学建议。
分享



