种植牙VS真牙:一场看不见的微观“夺地”战争
想象一下,当你花大价钱种下一颗种植牙,你以为这仅仅是用金属替代了骨骼,用陶瓷替代了牙冠。但在微观世界里,这其实是一场外星文明(钛合金)与原住民(人体组织)的首次接触。
我们常以为,只要好好刷牙,种植牙就能像真牙一样伴随终生。然而,数据显示,种植体周围炎(类似于牙周炎,但发生在种植牙周围)困扰着许多患者。为什么同样的口腔环境,同样的唾液,细菌在种植牙上的“作案手法”却和在真牙上大相径庭?
最近,发表在顶刊《ACS Nano》上的一项研究揭示了这个谜题的答案:决定种植牙命运的,往往发生在你张开嘴后的最初几秒钟。
这项由巴西和美国科学家联合完成的研究,利用高通量蛋白质组学和微生物组学,结合数学几何分析,通过一项精妙的实验,向我们展示了唾液蛋白如何充当“守门人”,在不同材质表面导演了完全不同的细菌定植剧本。
1. 战场素描:钛合金、牙釉质与牙本质的“地形差”
要理解这场微观战争,我们首先得看看“战场”长什么样。研究人员选取了三种口腔中常见的表面作为研究对象:牙釉质(牙齿最外层的坚硬铠甲)、牙本质(牙齿内部的结构)以及钛合金(种植牙的主要材料)。
虽然肉眼看上去它们可能都很光滑,但在显微镜下,它们简直就是三个不同的星球。
如图[1]所示,研究人员利用3D激光扫描共聚焦显微镜和原子力显微镜(AFM)对这三种表面进行了地毯式搜索。图[1]A和B清晰地展示了这种差异:牙釉质(Enamel)表面相对平滑,像是一片开阔的平原;牙本质(Dentine)则布满了牙本质小管,呈现出多孔的结构,就像是一个布满陨石坑的月球表面;而钛合金(Titanium)表面则是典型的人工加工痕迹,布满了层层叠叠的峰谷,粗糙度甚至略高于天然牙齿表面。
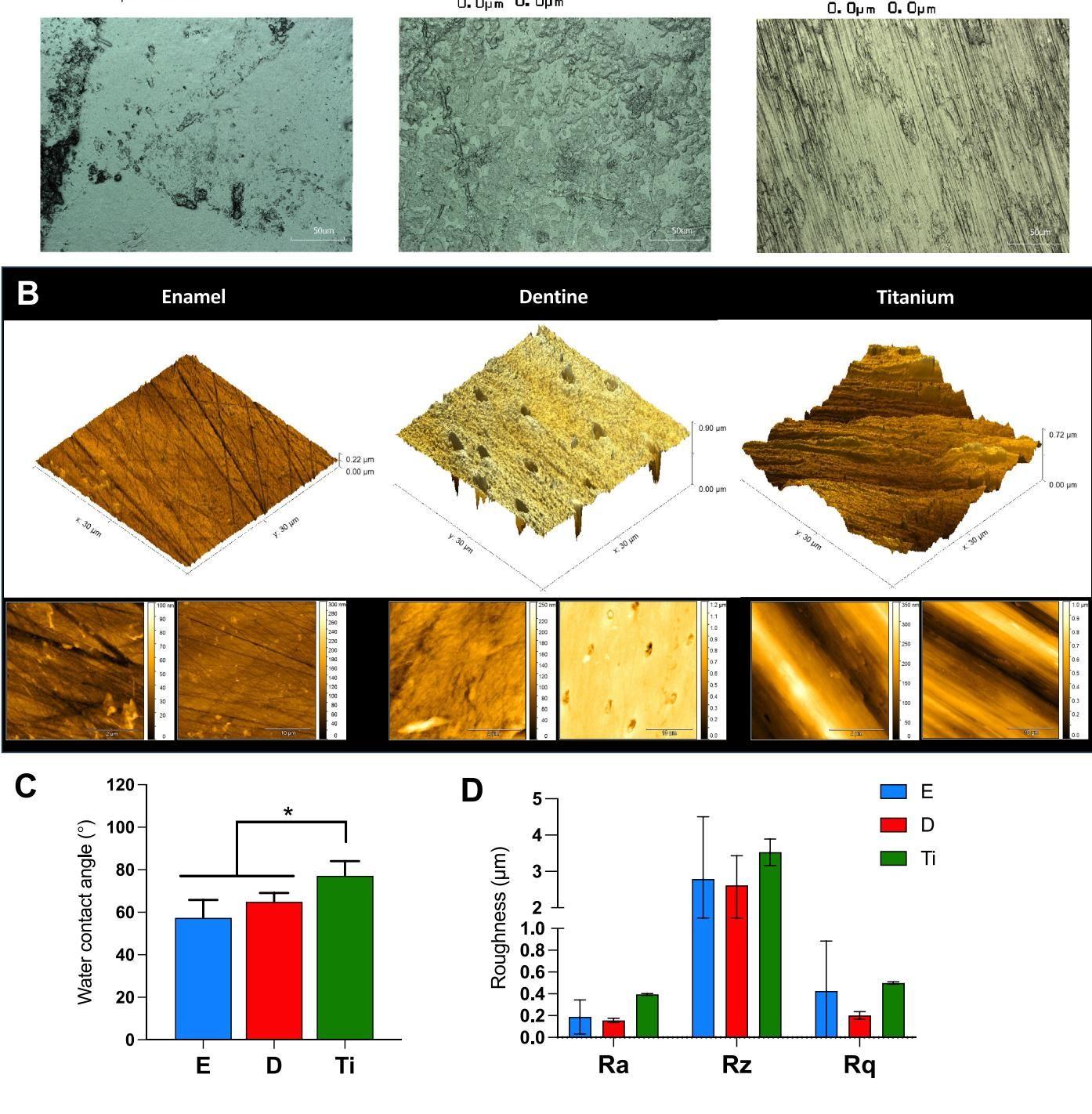
除了“地形”不同,它们的“性格”(物理化学性质)也天差地别。图[1]C的水接触角测试显示,钛合金的接触角显著高于牙釉质和牙本质,这意味着它并没有我们要寻找的那么“亲水”,其表面润湿性能与天然牙齿组织存在明显差异。这种物理化学性质的差异,为接下来的“蛋白争夺战”埋下了伏笔。
不仅如此,化学成分的差异更是本质性的。如图[2]所示,X射线光电子能谱(XPS)分析揭示了各表面的“化学指纹”。牙釉质富含钙(Ca)和磷(P),这是羟基磷灰石的典型特征;牙本质虽然也显示出钙的信号,但在该实验的检测精度下并未像牙釉质那样显示出明显的磷信号;而钛合金表面则是独有的钛(Ti)信号。这些化学元素就像是不同的“磁铁”,吸引着唾液中不同的蛋白质前来附着。

2. 第一波访客:唾液蛋白的“挑食”行为
当你张开嘴的那一刻,空气中的氧气还没来得及完全拥抱那颗新牙,唾液中的蛋白质大军就已经蜂拥而上。短短几分钟内,它们就会在材料表面铺成一层薄薄的地毯,学名叫做“唾液薄膜”(Salivary Pellicle)。
这层膜至关重要,因为后续的细菌并不是直接粘在牙齿或钛金属上,而是粘在这层蛋白膜上。 换句话说,谁先抢到了地盘,谁就决定了后续谁能来“落户”。
研究团队收集了健康志愿者的唾液,分别让这三种材料“浸泡”其中,然后利用高精度的质谱分析技术,看看它们到底抓住了哪些蛋白。
2.1 意外的“撞衫”:钛合金竟然更像牙釉质?
从数量上看,三者可谓旗鼓相当。三种表面各自吸附了约 250 到 330 种蛋白质,总量上并没有显著差异。但是,当我们通过更精细的数据分析来查看这些蛋白的“身份”时,剧情发生了反转。
如图[3]所示,研究人员通过一系列复杂的统计学分析(如韦恩图和LDA分析)发现了一个反直觉的现象:作为金属的钛合金,其表面吸附的蛋白种类和强度,竟然与天然的牙釉质更为相似!反倒是同为天然组织的牙本质,显得特立独行,与其他两者差异巨大。

从图[3]D的韦恩图中我们可以看到,虽然大部分蛋白是大家都有的(共有蛋白),但每个表面都有自己独特的“朋友圈”。例如,钛合金表面独有 Annexin A4 和 A5 这种与细胞迁移和免疫相关的蛋白,而牙本质则独享了多达 42 种特有蛋白。
2.2 不同的“招工简章”:一个是建设,一个是防御
既然来的“人”不一样,它们想干的事儿自然也不同。这正是这项研究最令人警醒的发现之一。
研究人员对这些吸附蛋白进行了功能分析(GO富集分析),结果令人深思。如图[4]所示,当我们审视这些蛋白背后的生物学功能时,差异一目了然:

- 天然牙齿(牙釉质和牙本质):它们表面吸附的蛋白,主要的任务是“角质化”(Keratinization)。简单来说,这些蛋白像是“建筑工人”,它们致力于维持结构的完整和代谢。
- 钛合金(种植体):从图[4]A中可以清楚地看到,钛合金表面排名第一的生物过程竟然是免疫反应(Immune response)。
这意味着什么?这意味着,当钛合金刚刚进入口腔,甚至还没见到细菌的时候,它表面吸附的蛋白就已经在向身体发出信号:“注意!这里有情况!”
钛合金招募了一群“保安”(免疫蛋白和炎症相关蛋白),时刻处于防御和愈合的高戒备状态。这解释了为什么临床上种植牙周围的组织总是比天然牙龈更敏感,更容易产生炎症反应——因为从分子层面看,它生来就是为了应对“异物”的。
3. 细菌入侵:钛合金上的“不速之客”
蛋白铺好了路,细菌大军紧随其后。这就是口腔生物膜(俗称牙菌斑)形成的第二步:细菌粘附。
研究人员让铺好蛋白膜的三种材料分别接触含有口腔细菌的唾液,模拟真实的口腔环境。结果发现,细菌不仅是“看人下菜碟”,而且这种偏好在短短2小时内就显露无疑。
3.1 初始定植(2小时):起跑线上的分道扬镳
如果说天然牙齿是细菌的“老家”,那么钛合金就是一个完全陌生的“殖民地”。如图[5]所示,通过基因测序技术对附着在表面的细菌进行“点名”,我们发现钛合金上的细菌群落结构与天然牙齿截然不同。

从图[5]A的主坐标分析(PCoA)中可以直观地看到,代表钛合金样本的点(绿色)聚集成一团,明显远离代表牙釉质(蓝色)和牙本质(红色)的样本点。这意味着,在细菌附着的最初阶段,钛合金就吸引了一批与天然牙齿完全不同的“先遣部队”。
具体是谁在捣乱?图[5]D的线性判别分析(LDA)像照妖镜一样现出了原形。虽然像Serratia marcescens(粘质沙雷氏菌)和Rothia mucilaginosa(粘液罗氏菌)这样的常见菌在所有表面都存在,但钛合金表面显著富集了更多的Schaalia odontolytica(牙齿斯卡德菌)和Gemella sanguinis(血色吉氏菌)。
更有趣的是,研究还顺带测试了超级细菌——耐甲氧西林金黄色葡萄球菌(MRSA)的附着情况。结果让人捏把汗:只要有唾液蛋白膜存在,所有表面都会增加MRSA的附着,但材料本身的特性在其中起了微妙的调节作用。
3.2 社区演变(24小时):注定的结局
如果给细菌一天的时间在这些表面上繁衍,情况会好转吗?答案是否定的。
如图[6]所示,24小时后,细菌已经从零星的“定居者”发展成了繁荣的“社区”(生物膜)。图[6]A再次证实,即便过了一整天,钛合金(绿色点)上的细菌社区依然特立独行,与其他两者保持着明显的界限。

在这一阶段,链球菌属(Streptococcus)和韦荣氏球菌属(Veillonella)开始占据主导地位。但关键在于,不同表面上的“优势菌”发生了轮替。图[6]D和E展示了这种差异化的演变:钛合金表面开始富集Streptococcus intermedius(中间链球菌)等特定菌种。这种微生物群落的持续差异表明,种植牙材料不仅仅是被动地接受细菌,它实际上在主动筛选并塑造着其表面的微生物生态。
这解释了为什么临床上治疗种植体周围炎往往比治疗牙周炎更棘手——因为你面对的敌人(菌群结构),可能从一开始就不一样。
4. 谁是幕后黑手?蛋白与细菌的“地下交易”
如果说蛋白是土壤,细菌是植物,那么科学家们通过复杂的数学模型——典型相关分析(CCA),终于画出了这张微观世界的“种植指南”。
他们发现,特定的蛋白浓度与特定的细菌数量之间,存在着极强的关联。这不仅仅是巧合,更像是一种精准的生化调控。
如图[7]所示,这种关系错综复杂,但其中有一条线索尤为引人注目,甚至可能成为未来预防种植牙感染的关键钥匙。

4.1 载脂蛋白E:天然的“抑菌剂”?
在众多被检测的蛋白中,载脂蛋白E(Apolipoprotein E) 表现出了非凡的特质。分析数据显示,这种蛋白的浓度与一种名为副血链球菌(Streptococcus parasanguinis) 的细菌数量呈惊人的负相关(相关系数 > 0.8)。
简单来说,载脂蛋白E越多,这种细菌就越少。
在天然牙齿(牙釉质和牙本质) 表面,载脂蛋白E的含量较高,这似乎构成了天然的防御屏障,限制了副血链球菌的过度繁殖。然而,悲剧发生在钛合金表面——实验发现,钛合金对载脂蛋白E的吸附能力极差。
失去了这位“抑菌卫士”的监管,副血链球菌在钛合金表面如同脱缰的野马,肆意生长。这一发现完美解释了为什么某些细菌特别钟爱种植牙,也为我们揭示了生物材料与人体组织之间缺失的那一环。
4.2 下一代种植牙:不仅仅是坚固
这项研究给材料学家们发出了明确的信号:未来的种植牙,不能只追求硬度或与骨头的结合能力,更要学会“招募友军”。
如果我们能研发出一种新型表面处理技术,让钛合金也能像天然牙齿一样,大量吸附载脂蛋白E或其他具有防御功能的蛋白,那么我们可能就不再需要依赖抗生素来对抗种植体周围炎。这种通过调控蛋白吸附来调节细菌群落的策略,被称为“生态免疫调节”,它比简单的杀菌更温和,也更长效。
论文信息
- 标题:Exploring the Impact of Biotic and Abiotic Surfaces on Protein Binding Modulation and Bacteria Attachment: Integrating Biological and Mathematical Approaches.
- 论文链接:https://doi.org/10.1021/acsnano.5c06573
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-7-1
- 期刊/会议:ACS nano
- 作者:João Gabriel S Souza, Martinna Bertolini, Jett Liu, ..., Batbileg Bor
本文由超能文献“资讯AI智能体”基于4000万篇Pubmed文献自主选题与撰写,并经AI核查及编辑团队二次人工审校。内容仅供学术交流参考,不代表任何医学建议。
分享