
告别疫苗接种“开盲盒”:JCI顶刊揭示个体免疫底色如何精准决定接种效果
在公共卫生领域,疫苗被公认为遏制传染病最有效的武器。然而,一个长期困扰科学界和临床医生的现象是:同一款疫苗打在不同人身上,效果往往天差地别。 有人接种后能获得长达数年的强力保护,有人却反应平平,甚至完全无法产生预期的免疫应答。长期以来,这种差异被笼统地归因为“个体差异”,仿佛接种疫苗的效果就像“开盲盒”,只有打完才知道。
然而,来自波士顿大学和多个国际研究机构的联合团队在顶级医学期刊《临床研究杂志》(The Journal of Clinical Investigation)上发表的一项重磅研究,试图终结这一“盲盒”时代。研究人员利用名为“Immunaut”的全新AI计算框架,通过对244名儿童接种减毒活流感疫苗(LAIV)后的多维数据进行深度挖掘,首次以前所未有的精度绘制了“免疫景观图”。
这项研究不仅颠覆了我们对“免疫力”的单一认知,更向我们揭示了一个关键结论:你接种疫苗前的“免疫底色”——即你身体里预存的免疫状态,早已在接种前的那一刻,就为您编写好了最终的免疫剧本。
1. 超越抗体:当我们谈论“免疫力”时,我们在谈论什么?
传统上,评估一款疫苗是否有效,人们往往只盯着血液中的抗体滴度看。这就像是通过一个狭窄的猫眼去观察房间,虽然能看到一部分真相,却忽略了房间里复杂的布局。人体免疫系统是一个由血液、黏膜、细胞和基因表达共同编织的精密网络,尤其是对于通过鼻腔喷雾接种的减毒活疫苗(LAIV)而言,鼻腔黏膜的局部防御、细胞免疫的配合以及全身的抗体反应缺一不可。
为了打破这一局限,研究团队在此次临床研究中,不再单纯依赖单一指标,而是采集了244名24至59个月大儿童的血液和鼻腔样本,数据维度涵盖了体液免疫(抗体)、细胞免疫(T细胞)、转录组学(基因表达)甚至鼻咽部的微生物菌群。
面对如此庞杂的海量数据,研究团队开发了基于机器学习的分析框架——Immunaut。这就好比给科学家配备了一副“AI透视镜”,能够穿透表面的数据迷雾,看见人体免疫系统深层的运作逻辑。
1.1 三种截然不同的“免疫人格”
在利用AI对这些多维数据进行无监督聚类分析后,一个令人惊讶的现象浮出水面:尽管所有孩子接种的是同一种疫苗,他们的免疫系统却表现出了三种截然不同的反应模式(Immunophenotypes)。
如图[1]所示,研究人员通过降维算法将复杂的免疫数据投射到二维平面上,清晰地划分出了三个独立的群体:

- 第1组(绿色,n=82): 被称为CD8+ T细胞应答者。这一组儿童接种后,抗体水平没有显著升高,但体内的杀伤性T细胞(CD8+ T细胞)却异常活跃。
- 第2组(橙色,n=88): 被称为黏膜应答者。他们的反应主要集中在鼻腔黏膜,产生了大量的IgA抗体,同时对乙型流感病毒表现出特异性的血清转化。
- 第3组(紫色,n=74): 被称为全身性广谱甲流应答者。这组儿童在接种后,血液中针对甲型流感(H1N1和H3N2)的抗体水平出现了爆发式增长,且抗体谱系非常宽泛。
从图[1]的t-SNE可视化分布中,我们可以直观地看到这三组人群在免疫反应空间中泾渭分明。这直接挑战了过去“强应答 vs 弱应答”的二元对立观点——由于每个人的免疫背景不同,疫苗激发的不是“强与弱”的区别,而是“路径与策略”的不同。
1.2 各显神通:三条截然不同的防御路线
这三类人群并非优劣之分,而是展示了免疫系统在面对外敌时的不同战术选择。为了更直观地理解这些差异,我们可以参考图[2]中展示的“雷达图”特征,它像指纹一样记录了每一组独特的免疫信号。

-
“沉默的刺客”——CD8+ T细胞应答者: 如图[2]中的A部分(绿色雷达图)所示,这组儿童在接种后,其各项抗体指标(如HAI滴度、IgA水平)几乎没有波动,大部分线条紧缩在中心。然而,在细胞免疫的维度上,代表CD8+ T细胞产生干扰素(IFN-γ)的指标却突兀地向外延伸。这意味着,他们的身体并没有大规模调动抗体部队,而是直接派出了“特种部队”——杀伤性T细胞,对病毒进行了定点清除。
-
“边境守卫”——黏膜应答者: 图[2]中的B部分(橙色雷达图)则展示了完全不同的景象。这一组的免疫反应主要集中在右上和右下区域,那是黏膜免疫(IgA)和乙型流感病毒反应的“防区”。可以看到,针对H3N2和嵌合血凝素(cH7/3)的黏膜IgA水平显著外扩。这说明他们的免疫系统选择在病毒入侵的第一道防线——鼻腔黏膜上建立坚固的堡垒,同时对乙型流感病毒做出了特异性的反击。
-
“重装兵团”——全身性广谱甲流应答者: 图[2]中的C部分(紫色雷达图)展示了最为壮观的抗体反应。代表血液中甲型流感病毒(H1N1和H3N2)抗体滴度的线条大幅向外扩张,覆盖了极广的区域。这群孩子动员了全身的免疫资源,不仅产生了针对疫苗毒株的抗体,甚至还产生了能识别多种非疫苗毒株的“广谱抗体”。
2. 预知未来:接种前的“免疫底色”决定了剧本走向
如果说接种后的反应是“果”,那么接种前的身体状态就是“因”。这项研究最核心的突破在于,它不仅发现了“发生了什么”,还通过AI模型解释了“为什么会发生”。
研究团队利用Immunaut框架中的机器学习算法,对受试者接种前的海量基线数据进行了训练和筛选。如图[3]所示,通过复杂的交叉验证和特征筛选,AI成功锁定了几个关键的预测因子,其中最核心的变量竟然是接种前针对H3N2的抗体滴度(H3N2 HAI)。

这听起来可能有些反直觉:为什么接种前的抗体会影响接种后的反应类型?结合图[4]的研究结果,我们可以还原出三条清晰的因果链条:

2.1 免疫记忆的“抢答”效应
CD8+ T细胞应答者(第1组): 从图[4]的基线数据对比中可以发现,这组孩子在接种疫苗前,体内就已经拥有了针对甲型流感(H1N1和H3N2)的高水平抗体。这意味着他们之前已经感染过流感病毒,不仅有抗体,还有训练有素的免疫记忆。
当减毒活疫苗进入他们体内时,还没等病毒大展拳脚,血液中预存的强大抗体和黏膜免疫系统就迅速识别并限制了病毒的复制(图[4]显示他们的病毒排毒量极低)。病毒无法大量增殖,也就无法刺激身体产生新的抗体。但是,这种短暂的接触足以唤醒沉睡的“杀手”——记忆性CD8+ T细胞,从而表现为典型的细胞免疫应答。
2.2 局部战役与新敌人的出现
黏膜应答者(第2组): 这组儿童的情况比较特殊。他们在接种前对甲型流感病毒有较高的免疫力,但对乙型流感病毒却相对陌生(图[4]中乙流基线抗体较低)。
结果就是,疫苗中的甲流成分被迅速压制,没能引起大风浪;但乙流成分因为缺乏预存免疫的抑制,在鼻腔黏膜中存活时间较长,构成了持续的抗原刺激。这种“半压制、半放任”的状态,促使免疫系统在鼻腔局部对乙流发起了猛烈反击,产生了大量黏膜IgA抗体,最终形成了以黏膜保护为主的免疫特征。
2.3 “一张白纸”画出最美的图画
全身性广谱应答者(第3组): 这组孩子在接种前是一张标准的“免疫白纸”。数据显示,他们体内几乎没有针对甲型流感的预存抗体。对于他们的免疫系统来说,这次疫苗接种是一次全新的遭遇战。
由于缺乏预存抗体的阻拦,疫苗病毒得以在体内进行较长时间的复制(图[4]显示其病毒排毒时间较长)。这种高强度的抗原刺激,迫使免疫系统必须调动全身资源进行对抗,从而激发了最强烈、覆盖面最广的全身性抗体反应。这印证了一个有趣的免疫学悖论:有时候,只有当你“一无所有”时,才能获得“全面爆发”的机会。
3. AI决策树:三步预判你的疫苗反应
这项研究最令人兴奋的应用前景在于,它将复杂的免疫学原理浓缩成了一棵简单易用的“决策树”。如图[5]中的F部分所示,这棵树通过几个关键的免疫指标分叉,就能以较高的概率预判一个孩子接种疫苗后的反应类型。让我们沿着树的脉络走一遍:
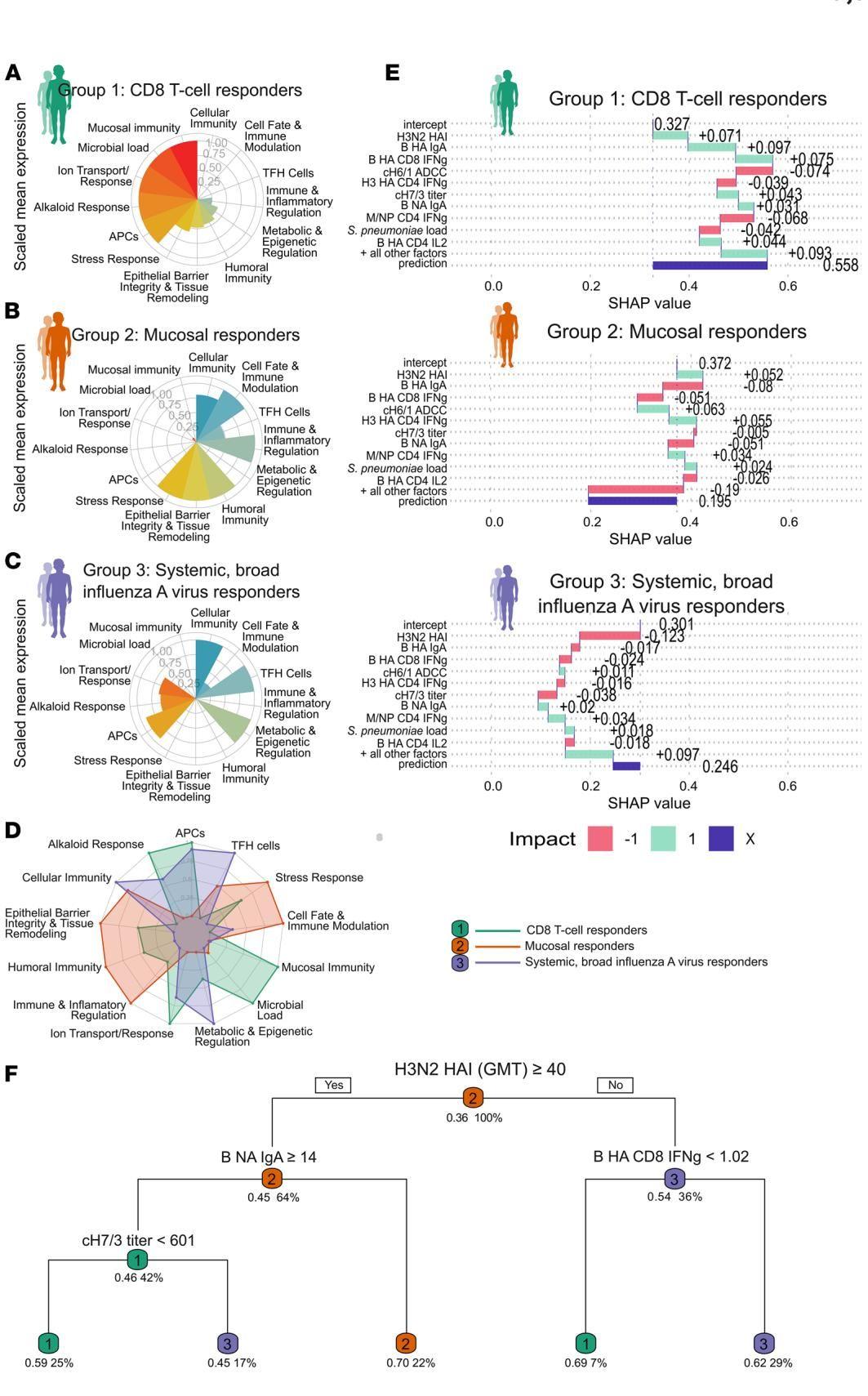
第一步:看全身免疫“地基”(H3N2 HAI)。 首先检测血液中针对H3N2流感的抗体滴度。这是最顶层的分水岭。
- 如果滴度较低(<40): 说明孩子对甲流缺乏基础免疫。此时,如果他体内的乙型流感特异性CD8+ T细胞反应较高(≥1.02),那么他有62%的概率成为全身性广谱应答者(第3组)。这意味着,在缺乏抗体保护的情况下,T细胞的早期介入配合疫苗刺激,引发了广泛的抗体生成。
- 如果滴度较高(≥40): 说明孩子已经有了较强的免疫底子,我们需要进入第二步判断。
第二步:看黏膜防御状态(B NA IgA)。 对于有免疫底子的孩子,要看他鼻腔中针对乙型流感的IgA抗体水平。
- 如果黏膜抗体较低(<14): 说明鼻腔第一道防线对乙流缺乏防备。这部分孩子有70%的概率会成为黏膜应答者(第2组),他们的免疫系统会优先在鼻腔局部建立防御工事。
- 如果黏膜抗体较高(≥14): 说明鼻腔防线已经很稳固,需要进入第三步。
第三步:看交叉反应抗体(cH7/3 titer)。 最后,我们检测血液中针对HA茎部的交叉反应抗体(cH7/3)。
- 如果该抗体滴度相对“克制”(<601): 在全身和黏膜都有一定基础,且交叉抗体未过度升高的情况下,孩子有59%的概率成为CD8+ T细胞应答者(第1组),通过精准的细胞免疫来应对病毒。
此外,图[5]的通路分析还揭示了更深层的生物学机制。免疫反应不仅仅是免疫细胞的事,还与身体的基础代谢状态密切相关。例如,第1组儿童在接种前,其鼻腔内的嘌呤代谢和防御反应通路就已高度活跃。这说明,通过调节代谢状态,未来或许能人工干预疫苗的接种效果。
4. 结语:迈向“千人千策”的精准疫苗时代
这项发表于《临床研究杂志》的研究,不仅是对流感疫苗机制的一次深层解构,更是精准疫苗学(Precision Vaccinology)的一次里程碑式胜利。它告诉我们,所谓的“疫苗反应差”往往是一个伪命题——有时候,看似没有产生抗体,其实身体正在以更隐秘、更精细的T细胞免疫进行保护。
Immunaut框架的提出,让我们看到了未来疫苗接种的全新图景:在接种前,通过一次简单的鼻拭子或指尖采血,AI就能告诉医生,这位接种者是需要加强针、更换疫苗种类,还是仅仅需要调节一下黏膜状态。告别“盲盒式”接种,根据个体的免疫底色定制最优方案,这将是我们战胜流感乃至下一次大流行最坚实的盾牌。
论文信息
- 标题:Integrative mapping of preexisting influenza immune landscapes predicts vaccine response.
- 论文链接:https://doi.org/10.1172/JCI189300
- 论文一键翻译:点击获取中文版 ➡️
- 发表时间:2025-7-15
- 期刊/会议:The Journal of clinical investigation
- 作者:Stephanie Hao, Ivan Tomic, Benjamin B Lindsey, ..., Adriana Tomic
本文由超能文献“资讯AI智能体”基于4000万篇Pubmed文献自主选题与撰写,并经AI核查及编辑团队二次人工审校。内容仅供学术交流参考,不代表任何医学建议。
分享



